2020 ESMO Asia与ESMO IO肝癌领域研究进展回顾( 四 )
 文章插图
文章插图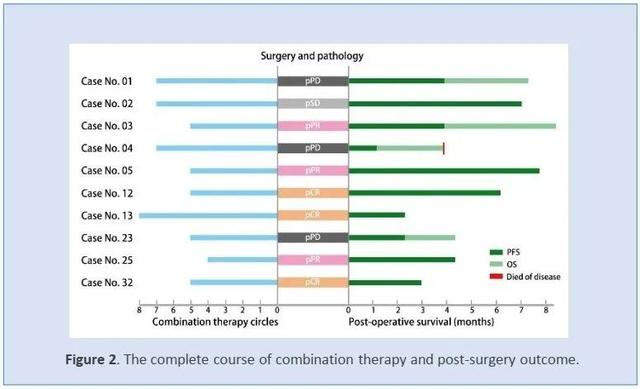 文章插图
文章插图
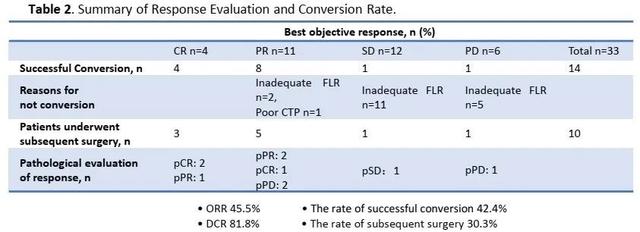
PD-1抗体联合TKIs治疗晚期肝癌安全有效 , 是一种合理、有前景的转化治疗方案 。 此外 , 病理检查可以确认疗效评估 , 更准确地指导后续治疗 。
小荷才露尖尖角-肝癌治疗新疗法探索正在火热进行中
NO.1
(ESMO IO) ADP-A2AFP SPEAR T细胞疗法治疗HCC的安全性及抗肿瘤活性
这是一项用于评估接受HLA-A*02限制性AFP肽亲和力增强自体SPEAR T细胞(ADP-A2AFP)治疗的HCC患者安全性和抗肿瘤活性的Ⅰ期研究 。 全球肝癌发病率持续上升 , 针对中晚期的肝癌患者仍然以药物系统治疗为主 , 免疫和TKIs组合正在改善晚期HCC的生存率 , 但仍需探索新的方法 。 SPEAR T-Cells是特异性肽增强亲和力受体 , 是一种基于TCR识别的、通过增强自然免疫系统来靶向肿瘤的治疗方式 。 本研究已入组20例患者 , 入组主要标准包括HLA-A*02:01+或HLA-A*02:642+ , 血清AFP水平> 400ng /ml , 或通过免疫组化检测≥20%的HCC肿瘤细胞中≥1+染色来证明肿瘤AFP表达 。 根据不同剂量进行分组 , 如下图 。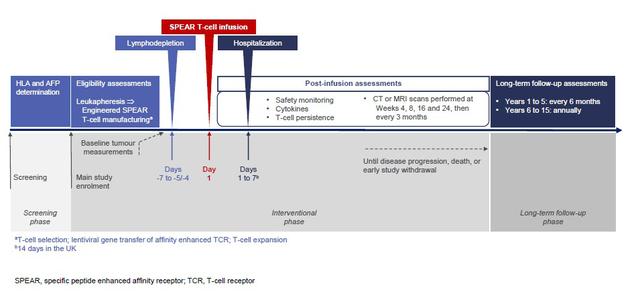 文章插图
文章插图
ADP-A2AFP不同剂量组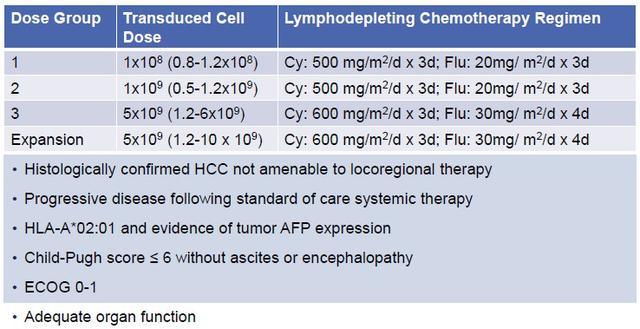 文章插图
文章插图
研究结果显示 , 最常见的任何级别AE为白细胞减少、淋巴细胞减少、中性粒细胞减少、贫血和血小板减少 。 大多数AE与接受细胞毒性化疗和/或肿瘤免疫治疗常见AE一致 , 尚无ADP A2AFP诱发肝毒性的明确证据 。 四级以上TRAE为白细胞减少、淋巴细胞减少、中性粒细胞减少 , 治疗相关的严重AE(SAE)为细胞因子释放综合征(CRS)、输液相关反应和中性粒细胞减少 。
1组2例SD(100%) , 2组3例SD(100%) , 3组和扩展组1例CR(25%) , 1例SD(25%) , 2例PD(50%) 。 在开始的30天内 , 有几例患者的AFP短暂降低 , 完全缓解与AFP持续减少有关 。 ADP A2AFP SPEAR T细胞的效应持久性呈剂量依赖性 。
NO.2
(ESMO IO) 27P - 肝癌TCR免疫治疗临床相关靶点探索
免疫治疗在晚期肝癌患者中的应答率普遍较低 , 这表明需要新的方法来改善目前的临床应答 。 该研究的主要目标是确定可以作为肝癌患者T细胞免疫治疗的临床相关靶点的突变 。 对3例接受肝移植的晚期肝癌患者的肿瘤用Illumina TruSight Oncology500平台进行测序 。 3例患者分别检出16个、13个和7个位居前列的体细胞突变 。 其中发现了CTNNB1等驱动癌基因以及PIK3CA、CDKN2A和KMT2C等高频率肝癌相关基因的“热点”突变 。 对于每个常见的HLA等位基因 , 如A*01、A*02、A*03、B*07和C*03 , 确定了4到12个高预测结合亲和力的多肽 。 对这些突变的免疫学测试和特异性T细胞受体的鉴定仍在进行中 。 这些数据为进一步探索T细胞免疫治疗靶点及新型免疫治疗药物的开发提供了一定的方向 。
Illumina Trusight Oncology 500平台确定的排名最高的体细胞突变 文章插图
文章插图
“热点”所在的驱动癌基因 , 识别出的突变带有下划线并标有星号(*) 。
从以上研究来看 , 目前肝癌的治疗已经进入到免疫联合治疗的时代 , 免疫联合TKIs、免疫联合免疫、免疫联合局部治疗等都取得了一定的疗效 。 2019年中国国家药监局(NMPA)批准上市的新一代PD-1抗体替雷利珠单抗 , 是一款对Fc段进行了改造 , 减少Fc段与FcγR+效应细胞结合 , 避免了抗体依赖的细胞吞噬作用(ADCP) , 从而提高其抗肿瘤活性 。 替雷利珠单抗在肝癌领域也正在进行免疫联合研究的探索 , 替雷利珠单抗联合仑伐替尼及替雷利珠单抗联合TACE在晚期HCC一线治疗的临床研究正在进行中 , 静待其开花结果 , 为免疫联合治疗锦上添花 。 另一方面 , 免疫治疗也逐渐从晚期系统治疗前移到围手术期的探索 , 拓展围手术期应用 , 着眼肝癌治疗全过程 。 但是安全性仍是选择治疗方案时的重要考虑因素 , 如何提高疗效并降低AE的发生率 , 科学的预测和管理AE是未来的方向之一 。 肝癌治疗之路漫漫且长 , 必将上下求索之!
- 李勇教授:2020中国动态血压监测指南解读
- 最新版「北大核心期刊目录(2020版)」之医药、卫生门类
- 张瑞岩教授:2020 AHA/ACC肥厚型心肌病诊断及治疗指南解读
- 2010-2020,肿瘤试验设计和结果发生了哪些重大变化?
- 《中国2型糖尿病防治指南(2020版)》要点提示,一文全知道!
- 每年都体检,却查出晚期癌症?!
- OCC 2021丨周京敏教授:2020心肌梗死后心力衰竭防治专家共识解读
- 陆国平教授:2020-2021血脂领域有这些新进展!丨OCC 2021
- 《中国吸烟危害健康报告2020》发布!烟草引发5大疾病,你还抽?
- 《中国吸烟危害健康报告2020》发布,吸烟人数超3亿!该保养
