基线空腹血糖水平与急性胰腺炎发病风险的前瞻性队列研究( 三 )
<0.01 , 见表1) 。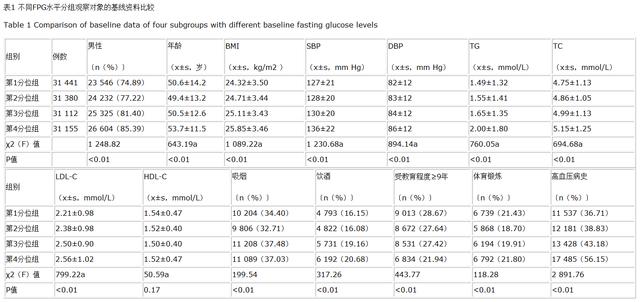 文章插图
文章插图
注:第1分位组为FPG≤4.69 mmol/L , 第2分位组为FPG>4.69~5.13 mmol/L , 第3分位组为FPG>5.13~5.72 mmol/L , 第4分位组为FPG>5.72 mmol/L;FPG=空腹血糖 , BMI=体质指数 , SBP=收缩压 , DBP=舒张压 , TG=三酰甘油 , TC=总胆固醇 , LDL-C=低密度脂蛋白胆固醇 , HDL-C=高密度脂蛋白胆固醇;a为F值;1 mm Hg=0.133 kPa
2.2 不同FPG水平分组患者急性胰腺炎发病情况比较 在平均(10.14±1.71)年随访期间 , 共发生急性胰腺炎297例 , 总人群急性胰腺炎发病密度为2.34/万人年 , 其中FPG≤4.69 mmol/L组新发急性胰腺炎59例 , 发病密度为1.83/万人年;FPG>4.69~5.13 mmol/L组和FPG>5.13~5.72 mmol/L组新发急性胰腺炎分别为76例和63例 , 发病密度分别为2.38/万人年和2.00/万人年 , FPG>5.72 mmol/L组新发急性胰腺炎99例 , 发病密度为3.18/万人年 。 4组急性胰腺炎的累积发病率分别为0.20%、0.26%、0.23%、0.37% , 经Log-Rank检验 , 差异有统计学意义(χ2=13.41 , P=0.004 , 见表2) 。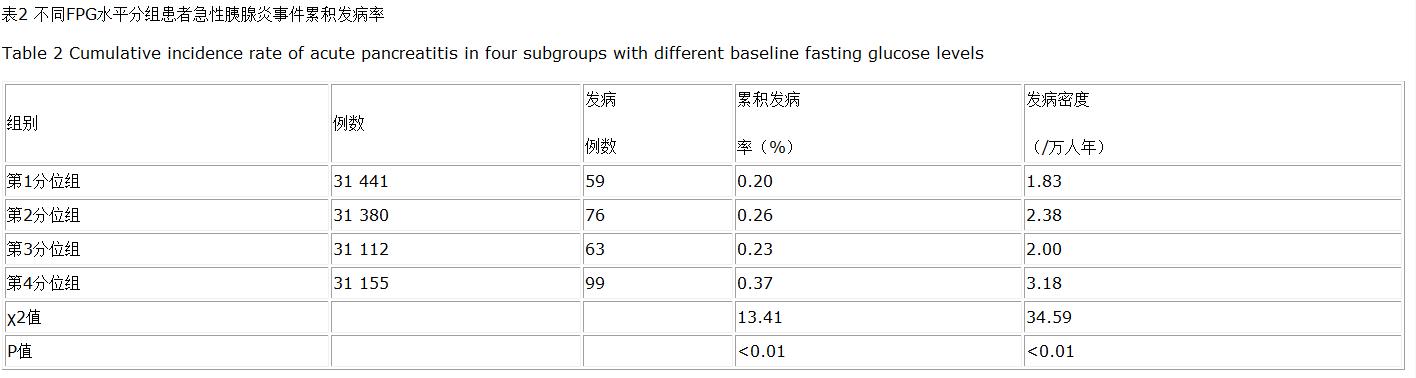 文章插图
文章插图
2.3 不同FPG水平分组影响急性胰腺炎事件的Cox比例风险模型 以是否发生急性胰腺炎事件为因变量(赋值:否=0 , 是=1) , 基线空腹血糖FPG水平4个分组为自变量(赋值:FPG≤4.69 mmol/L组=0 , FPG>4.69~5.13 mmol/L组=1 , FPG>5.13~5.72 mmol/L组=2 , FPG>5.72 mmol/L组=3) , 进行Cox比例风险回归模型分析 。 模型1以第1分位组(FPG≤4.69 mmol/L)为对照 , 第2分位组、第3分位组和第4分位组发生急性胰腺炎的HR(95%CI)分别为1.31(0.93 , 1.84)、1.11(0.77 , 1.58)和1.76(1.27 , 2.42) 。 模型2在模型1的基础上校正了年龄、性别(赋值:性别男=0 , 女=1;年龄以实际值纳入) , 结果显示:第2分位组、第3分位组和第4四分位组发生急性胰腺炎的HR(95%CI)分别为1.33(0.95 , 1.87)、1.11(0.78 , 1.58)和1.69(1.22 , 2.33) 。 模型3在模型2的基础上进一步校正了BMI、TG、TC、HDL-C及吸烟、饮酒、受教育程度、体育锻炼和高血压病史(赋值:吸烟、饮酒、体育锻炼和高血压病史:否=0 , 是=1;受教育程度<9年=0 , ≥9年=1;余自变量以实际值纳入) , 结果显示:第2分位组、第3分位组和第4分位组发生急性胰腺炎的风险的HR(95%CI)分别为1.26(0.89 , 1.78)、1.01(0.70 , 1.45)和1.44(1.04 , 2.01)(见表3) 。
2.4 敏感性分析 急性胰腺炎时胰腺受损 , 胰岛细胞因炎性坏死导致胰腺功能不全 , 造成胰岛素分泌不足或胰岛素抵抗 , 导致血糖代谢紊乱[16] 。 为排除反向因果关系 , 去除随访1年内发生急性胰腺炎的观察对象 , 重新进行分析 , 校正因素与模型3相同 , 多因素Cox比例风险回归分析显示:与第1分位组比较 , 第2、3、4分位组发生急性胰腺炎的HR(95%CI)分别为1.19(0.83 , 1.71)、1.01(0.69 , 1.47)、1.44(1.01 , 2.03)(见表3) 。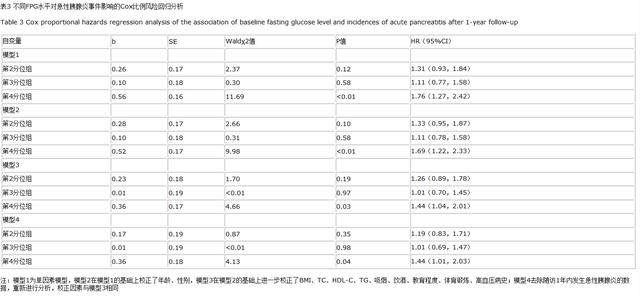 文章插图
文章插图
3 讨论
临床上 , 急性胰腺炎患者公认的病因主要有胆石症、高脂血症、酗酒 , 以及手术创伤应激、药物等 , 我国以胆石症为首位致病因素 。 随着生活水平的提高及饮食结构的改变 , 糖尿病患者逐渐增多 。 急性胰腺炎时常合并高血糖 , 但高血糖是否为急性胰腺炎的高危因素尚有争议 。 有大型前瞻性队列研究报告了急性胰腺炎住院时糖尿病发生率为18% , 糖尿病增加了急性胰腺炎发生的风险[17-18] 。 亦有报道指出FPG>6.4 mmol/L是胰腺癌发病的独立危险因素[19] 。 但国内外目前尚无高血糖是否为急性胰腺炎的独立危险因素的相关报道 。
- 糖尿病|医生说|血糖有个高危数值,离糖尿病只有一步,多数人却不自知!
- 血糖高,就这样做,轻松降血糖,安全可靠无副作用!
- 疾病|糖尿病是“养”出来的?医生告诫:想要血糖稳,平时少碰这4物
- 糖尿病人把血糖控制住就OK了?不幸的是,您及您的医生都错了
- 女性清晨空腹食用一宝,脂肪没了,皮肤年轻细腻,衰老也更慢
- 漫画 | 那个控制不了血糖平稳的人,会是我吗?
- 只是血压、血糖有些高,但血脂不高,为什么还要吃阿托伐他汀?
- “升糖”食物已列出清单,白糖不在列,高血糖患者,建议平时少碰
- 高血压、高血糖、高血脂,“三高”人群不能吃什么?都在这里了
- 血糖升高,竟是肺癌惹的祸!这种特殊肺癌还和多种疾病相关!
