2020年NMPA官宣批准上市的“中国1类新药”( 二 )
2018年10月 , 泽布替尼胶囊用于复发/难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者潜在疗法的NDA获NMPA受理;2018年11月 , 泽布替尼用于复发性或难治性边缘区淋巴瘤(R/R MZL)的II期开放性研究在中国进行;2019年1月 , 百济神州的BTK抑制剂泽布替尼获FDA授予的突破性疗法认定 , 用于治疗先前至少接受过一种治疗的成年套细胞淋巴瘤(MCL)患者 , 成为首获美突破性疗法认定的中国本土抗癌药;2019年8月20日 , 该药的临床试验申请获得CDE承办10月得到CDE的临床试验默示许 , 用于治疗复发/难治性弥漫性大B细胞淋巴瘤 。
5
盐酸拉维达韦片
(2020.07)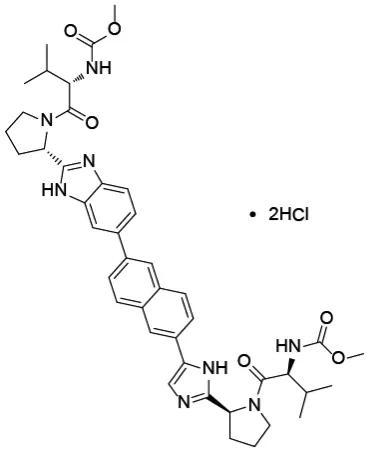 文章插图
文章插图
开发公司为歌礼生物 , 最新一代NS5A抑制剂 , 可抑制病毒RNA复制;NS5A是一种多功能蛋白 , 是HCV复制复合体的基本组成部分 。 2020年7月获NMPA批准上市 , 联合利托那韦强化的达诺瑞韦钠片和利巴韦林 , 用于治疗初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者 , 不得作为单药治疗 , 商品名“新力莱” 。
2015年4月 , 拉维达韦的临床试验申请(化药1类)获得NMPA受理;2016年5月 , 拉维达韦获得临床试验批件;2018年8月 , 拉维达韦上市申请获NMPA受理;2018年8月 , 拉维达韦作为未来泛基因型直接抗病毒药物被WHO纳入2018年7月最新版的丙肝治疗指南 。
6
盐酸恩莎替尼胶囊
(2020.11)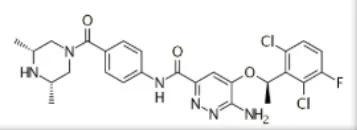 文章插图
文章插图
最初的开发公司为Xcovery , 2014年授权给贝达药业;为一种间变性淋巴瘤激酶(ALK)抑制剂 , 对TRKA融合、TRKC、ROS1、EphA2和c-MET也具有潜在的抑制活性 。 2020年11月获NMPA批准上市 , 用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗 , 商品名“贝美纳” 。
2015年11月 , 贝达药业于国内申报中国化药1.1类临床研究 , 且于2016年8月获得临床试验批件;2016年10月 , 由贝达药业、Xcovery、Cotalent在中国提交的临床申请(进口1类)获CDE承办 , 且于2017年5月获得批准开展全球多中心临床III期试验;2018年12月 , 在中国的NDA获得NMPA受理 , 用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的ALK阳性的局部晚期或转移性NSCLC;2019年2月 , 被NMPA拟纳入优先审评程序 。
7
环泊酚乳状注射液
(2020.12)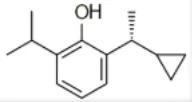 文章插图
文章插图
开发公司为海思科药业 , 是GABAA受体激动剂 , 为麻醉镇静药 。 2020年12月获NMPA批准上市 , 临床用于消化道内镜检查中的镇静 , 商品名“思舒宁” 。
2014年9月 , 海思科药业在中国申报此药中国化药1.1类临床研究 , 并于2016年3月获得临床批件;2018年10月 , 一项在结肠镜和胃镜诊疗受试者中评价环泊酚镇静/麻醉有效性和安全性的多中心、随机双盲、丙泊酚对照的III期研究在中国完成首例受试者入组;2019年8月 , NMPA承办了海思科关于环泊酚乳状注射液的NDA申请 。 2020年2月20日 , 环泊酚乳状注射液的上市申请被CDE纳入拟优先审评品种 。
8
氟唑帕利胶囊
(2020.12)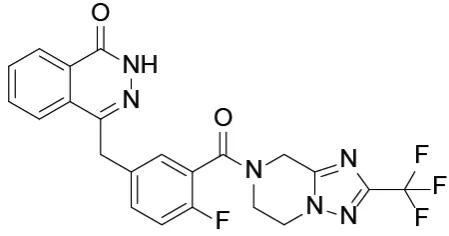 文章插图
文章插图
开发公司为江苏恒瑞 , 属小分子PARP抑制剂 , 可抑制BRCA1/2功能异常细胞中的DNA修复过程 , 诱导细胞周期阻滞 , 进而抑制肿瘤细胞增殖 。 2020年12月获NMPA批准上市 , 临床用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗 , 商品名“艾瑞颐” 。
- 官宣!大批耗材集体砍价:美敦力、乐普、微创(附名单)
- 官宣:中山六院胃外科正式成立
- 【一图一药】撤市9年后,人福医药的磷丙泊酚二钠以中国一类新药上市申请获NMPA批准!
- 每年都体检,却查出晚期癌症?!
- NASH在研新药ASC42,获得NMPA批准,将在我国开展临床研究
- 我国发布首个《肺癌MRD的检测和临床应用共识》
- 2020年“十大民生实事”盘点⑩丨永康完成全消化道肿瘤早期筛查5万多人次
- FDA发布2020年新药年度报告,孤儿药获批占大头
- 万古霉素治疗药物监测,2020年指南推荐意见一览
- 淄博六中校友张彬博士入选2020年齐鲁卫生与健康领军人才
