骨髓增生异常综合征中国诊断与治疗指南(2019年版)( 二 )
所有怀疑为MDS的患者均应行骨髓活检 , 通常在髂后上棘进行 , 长度不少于1.5 cm 。 骨髓活检细胞学分析有助于排除其他可能导致血细胞减少的因素或疾病 , 并提供骨髓细胞增生程度、巨核细胞数量、原始细胞群体、骨髓纤维化程度及肿瘤骨髓转移等重要信息 。 怀疑为MDS的患者应行Gomori银染色和原位免疫组化(immunohistochemical , IHC) , 常用的检测标志包括CD34、MPO、GPA、CD61、CD42、CD68、CD20和CD3 。
2.细胞遗传学检测:
所有怀疑MDS的患者均应进行染色体核型检测 , 通常需分析≥20个骨髓细胞的中期分裂象 , 并按照《人类细胞遗传学国际命名体制(ISCN)2013》进行核型描述 。 40%~60%的MDS患者具有非随机的染色体异常 , 其中以+8、-7/del(7q)、del(20q)、-5/del(5q)和-Y最为多见 。 MDS患者常见的染色体异常中 , 部分具有诊断价值(表4) , 而+8、del(20q)和-Y亦可见于再生障碍性贫血及其他血细胞减少疾病 。 形态学未达到标准(一系或多系细胞发育异常比例<10%)、但同时伴有持续性血细胞减少的患者 , 如检出具有MDS诊断价值的细胞遗传学异常 , 应诊断为MDS未分类型(MDS-U) 。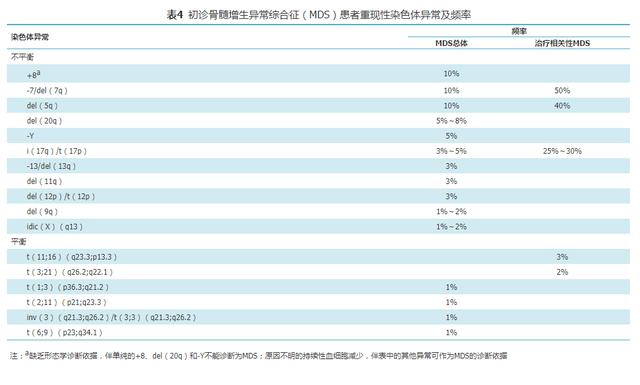 文章插图
文章插图
表4 初诊骨髓增生异常综合征(MDS)患者重现性染色体异常及频率
应用针对MDS常见异常的组套探针进行荧光原位杂交(FISH)检测 , 可提高部分MDS患者细胞遗传学异常检出率 。 因此 , 对疑似MDS者 , 骨髓干抽、无中期分裂象、分裂象质量差或可分析中期分裂象<20个时 , 应进行FISH检测 , 通常探针应包括:5q31、CEP7、7q31、CEP8、20q、CEPY和TP53 。
3.流式细胞术(FCM):
目前尚无MDS特异性的抗原标志或标志组合 。 对于缺乏确定诊断意义的细胞形态学或细胞遗传学表现的患者 , 不能单独依据FCM检测结果确定MDS诊断 。 但FCM对于MDS的预后分层以及低危MDS与非克隆性血细胞减少症的鉴别诊断有应用价值 。 对于无典型形态学和细胞遗传学证据 , 无法确诊MDS的患者 , FCM检测结果可作为辅助诊断标准之一 。
4.分子遗传学检测:
新一代基因测序技术可以在绝大多数MDS患者中检出至少一个基因突变 。 MDS常见基因突变包括TET2、RUNX1、ASXL1、DNMT3A、EZH2、SF3B1等(表5) 。 常见基因突变检测对MDS的诊断有潜在的应用价值 , 如SF3B1基因突变对MDS伴环状铁粒幼红细胞(MDS-RS)亚型有重要诊断和鉴别诊断价值 , 应为必检基因 。 部分基因的突变状态对MDS的鉴别诊断和危险度分层中有一定的价值 , 推荐作为选做检测项目 , 包括:TP53、TET2、DNMT3A、IDH1/2、EZH2、ASXL1、SRSF2、RUNX1、U2AF1、SETBP1等 。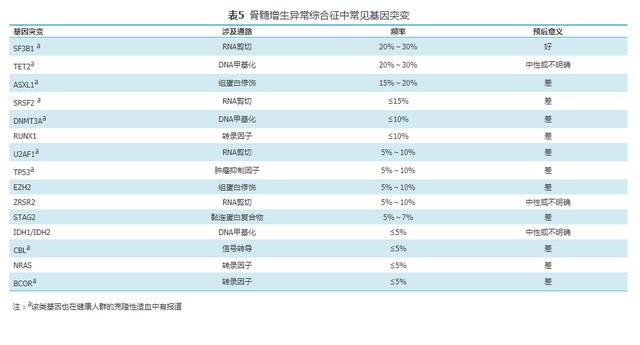 文章插图
文章插图
表5 骨髓增生异常综合征中常见基因突变
基因测序报告的正确解读对于充分体现基因突变检测的价值、避免结果误导临床诊疗极为重要 。 测序结果应参考OMIM、HGMD、ACMG和COSMIC等数据库分析其病理意义 , 对于未在主要数据库或参考文献中描述的新序列变异可使用口腔黏膜、唾液、指甲或毛囊鉴别其为体细胞获得性还是胚系来源 。 胚系来源基因突变在MDS及遗传易感髓系肿瘤患者中可能具有病理意义 。 此外 , 有基因突变并不代表能够确立MDS诊断 , 对于基因突变在MDS诊断中的价值应结合其他指标审慎判断 。
单核苷酸多态性-微阵列比较基因组杂交技术(SNP-array)等基因芯片技术可以在多数MDS患者中检测出DNA拷贝数异常和单亲二倍体 , 进一步提高MDS患者细胞遗传学异常的检出率 , 在有条件的单位可作为常规核型分析的有益补充 。
二、分型建议
1.FAB分型(表6):
- 疾病预防|肝纤维化刚开始时,身体隐约有5个异常,别等肝硬化才知晓!
- 常放屁是肝不好吗?肝病主任:若身体3“异常”,可能需要养肝了
- 进入更年期的女性,除了失眠,身体的异常情况,也要多留个心眼
- 高血压会引起手指“异常”,你知道吗?医生提醒:早发现早治疗
- 视频 | 眼睛出现这几种异常,可能是眼眶疾病的“信号”
- 抑郁症|抑郁症患者身上,表情和言语或能看出异常,身边有人中招,别忽视
- 骨髓源性生长因子(MYDGF)参与动脉粥样硬化的调控
- 养生|排尿时出现异常情况,是肾脏“坏了”?留意看看你有没有?
- 前列腺增生用药有什么要注意?这4点记牢了
- 结节|出现结节、囊肿、增生是怎么一回事?三者有何区别?
