「2020SITC」赵军教授:RATIONALE 001/102研究NSCLC队列汇总分析及对免疫热肿瘤耐药机制的探索( 二 )
 文章插图
文章插图
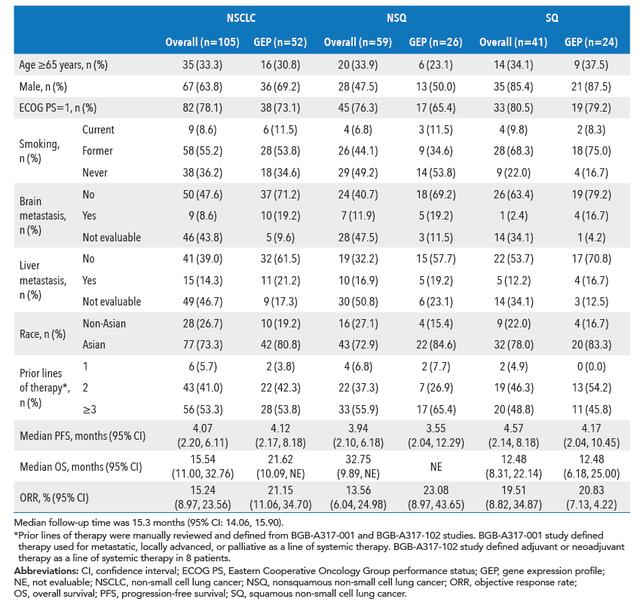
图1 NSCLC总人群和基因谱分析人群
基线特征和预后结果
Biomarker分析
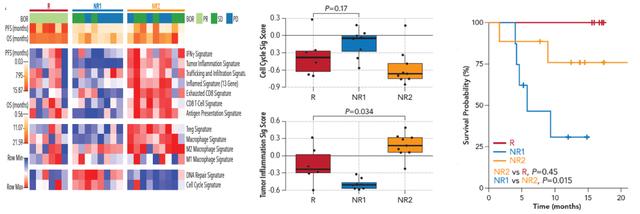
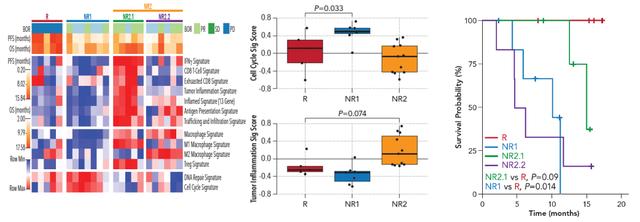
根据患者对替雷利珠单抗治疗应答情况将可分析基因谱的患者(GEP-Evaluable)分为治疗应答组(Responder,R组)和不应答组(Non-responder,NR组) 。 免疫治疗不应答患者也就是NR组患者 , 又根据免疫相关基因表达和肿瘤相关基因表达的高低分为NR1和NR2两个亚组 , NR1组患细胞周期相关基因标记评分较高 , NR2组患者肿瘤炎性基因标记评分较高 , 可被归类为免疫热肿瘤 。 鳞癌NR2组患者又根据免疫“热”肿瘤程度的高低 , 分为NR2.1和NR2.2两组 , 其中NR2.1组患者免疫“热“的程度更高 。 与治疗应答组患者也就是R组患者相比 , NR1组患者细胞周期相关基因标记评分较高 , 炎性基因标记呈下降趋势;NR2组患者肿瘤炎性基因标记与R组相比评分更高 。 生存曲线显示非鳞癌NR2组患者与R组患者OS相当(P=0.45) , 优于NR1组患者(P=0.015) , 鳞癌NR2.1组患者OS有优于NR1组患者的趋势(如图2和图3) 。
 文章插图
文章插图
图2 非鳞NSCLC患者基因标记
 文章插图
文章插图
图3 鳞状NSCLC患者基因标记
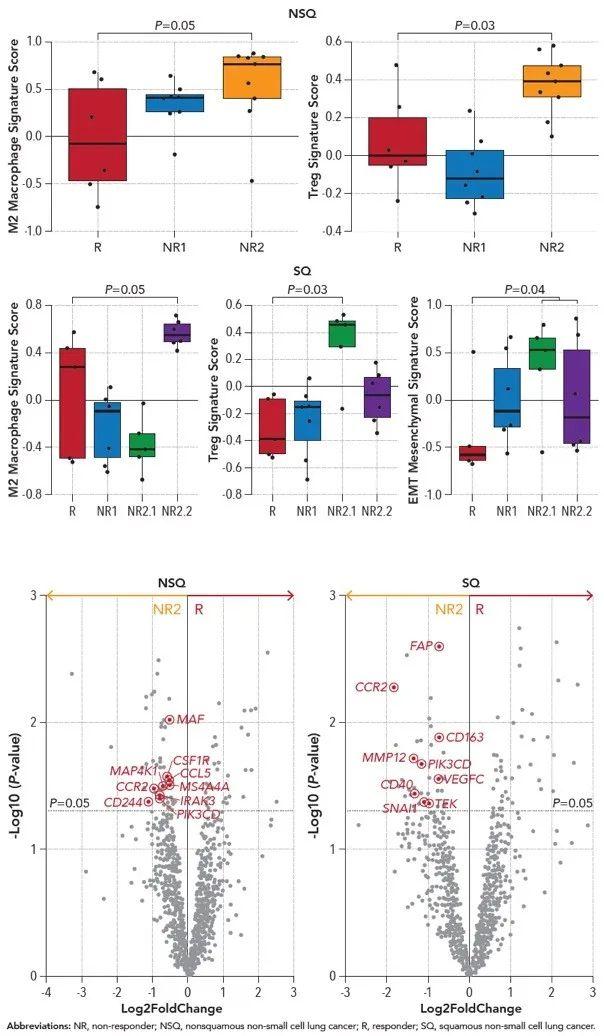
为探索免疫热肿瘤但免疫治疗不应答患者的耐药机制 , 对患者基因表达标记进行分析 , 结果显示鳞癌和非鳞癌NR2组患者M2型巨噬细胞和Treg细胞相关基因标记评分较高(P≤0.05) 。 NR组鳞癌患者上皮细胞间质转型(EMT)相关基因标记评分较高 , 但这种情况在非鳞癌患者中并未出现 , 表明鳞状NSCLC肿瘤自身的特点也可能与免疫治疗耐药相关 。 通过对不同基因表达情况进一步分析发现 , 非鳞癌NSCLC患者的免疫调节相关基因中PIK3CD,IRAK3和MAP4K1(P<0.05)的表达水平明显升高 , 巨噬细胞相关基因中CSF1R,CCR2, CCL5, CD244, MAF和MS4A4A(P<0.05) 的表达水平明显增高;鳞状NSCLC患者PIK3CD,CCR2, CD40, CD163和MMP12基因(P<0.05)表达水平明显增高;而且鳞癌患者上皮细胞间质转型相关基因和血管生成相关基因中的SNAI1,FAP, VEGFC和TEK(P<0.05)也同样表达增高(如图4) 。
 文章插图
文章插图
图4 免疫热肿瘤但治疗不应答患者
基因标记与表达情况
研究同样也探索了基因突变在免疫耐药中可能扮演的角色 , 对8例可评估的免疫热肿瘤但治疗不应答患者的基因突变情况进行了分析 。 非鳞NSCLC患者 , 5例患者中有4例存在基因突变 , 包括JAK2和STK11功能失活突变或RET和ROS1融合;鳞状NSCLC患者 , 3例可评估患者均存在MDM2扩增或FGFR扩增、PIK3CA扩增伴BRAF激活突变(如图5) 。 这些驱动基因突变和耐药相关基因突变在免疫治疗应答患者中并未发现 , 提示基因突变与免疫热肿瘤的免疫治疗耐药密切相关 。
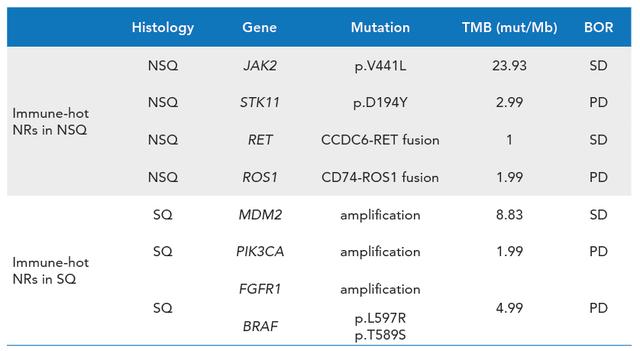 文章插图
文章插图
图5 免疫热肿瘤但治疗不应答患者
耐药基因和驱动基因突变情况
参考文献
1. Jayesh Desai, et al. Potential Mechanisms of resistance identified through analysis of Multiple biomarkers in immune-hot non-response with non-small cell lung cancer treated with tisleilizumab, 2020 SITC, Poster:76
【「2020SITC」赵军教授:RATIONALE 001/102研究NSCLC队列汇总分析及对免疫热肿瘤耐药机制的探索】仅供医疗卫生专业人士参考 , 文章内容可能含有未在中国批准的临床适应症 , 处方请参考国家药品监督管理局批准的药品说明书 。
- 高血脂|每天吃洋葱可以降血脂?协和教授:真正的降血脂的是这两件事
- 不孕不育专家刘效群教授来青县人民医院生殖门诊坐诊
- 「长程管理大家谈」王雪鹰教授:提高院内院外治疗延续性,长程项目助力糖尿病患者长期血糖管理
- 「长程管理大家谈」章秋教授:院内院外一体化,长程管理项目助力糖尿病慢病综合管理之路
- 「长程管理大家谈」刘素荣教授:精细化与精准化结合,多方协作助力糖尿病血糖长程管理
- 知名专家田云霄:镜中方寸间断出“金标准”——记邯郸市中心医院病理科主任田云霄教授及团队
- 「长程管理大家谈」都健教授:实施精细化分层管理,完善院内院外血糖管理工作
- 上海六院殷峻教授:胆固醇没问题,不要吃他汀类降脂药,可能有害
- 医学界儿科频道|恰当处理神经科急症!,知名教授教你
- 侃鉴历史|真正补钙的是2件事,多喝牛奶可以补钙?北大教授:大错特错
