Nat Med | 澳大利亚首个国家级儿童癌症精准医学项目
撰文 | 柠檬树
责编 | 兮
尽管癌症的诊断和治疗技术已经取得了一定程度上的进步 , 但在大多数发达国家 , 癌症仍是儿童主要的致死疾病【1】 。 高危儿科癌症患者通常患有侵袭性肿瘤 , 5年生存率不到30% , 几乎没有既定治疗方案 。 近来在精准医学的指导下 , 新的靶向疗法和免疫疗法被发掘出巨大的潜力 。 依据肿瘤分子特征的变化来制定个性化疗法 , 可以更有效地控制癌症 , 并减少治疗带来的副作用【2】 。
然而 , 个性化儿童癌症的治疗也面临着独特的挑战:1) 仅45%的儿童癌症与成人癌症有着相同的驱动基因【3,4】 , 因此儿童癌症需要新的治疗药物;2) 儿童癌症通常是由结构性变异(structural variants, SVs) 驱动的 , 这些变异难以识别和靶向;3) 许多新的靶向药物缺乏对儿童用药剂量的指导以及详细的疗效数据 。 因此 , 针对儿童的特异性疗法是个性化医疗至关重要的部分 。
近日 , 澳大利亚儿童癌症研究所 (Children’s Cancer Institute) 的Mark J. Cowley, Paul G. Ekert以及David S. Ziegler在Nature Medicine杂志上发表了文章“Whole genome, transcriptome and methylome profiling enhances actionable target discovery in high-risk pediatric cancer” , 组建了澳大利亚第一个国家级儿科癌症精准医学计划——儿童零癌症项目(Zero Childhood Cancer Program) , 实时招募和分析高危儿科癌症患者 。 研究首次系统性地评价了源自不同平台的综合分子谱 , 发现了与肿瘤生物学、临床诊断、预后相关的可指导临床治疗的变异 。 与此同时 , 这项研究首次综合评估了澳大利亚高危儿科癌症患者肿瘤易感基因胚系突变的发生率和频谱 。 文章插图
文章插图
儿童零癌症计划在2015年至2019年间招募了不同癌症种类、癌症阶段、患者年龄以及采用不同治疗方法的247位儿科癌症患者(包括21岁以上的肿瘤类型是儿科肿瘤亚型或儿科肿瘤复发的患者) 。 这些肿瘤可以分为中枢神经系统肿瘤、肉瘤、非肉瘤性颅外实体瘤、神经母细胞瘤和血液系统恶性肿瘤五个类别 , 囊括了初步诊断、复发、难治性以及治疗引起的继发性等不同肿瘤阶段 。 研究前瞻性地整合了全基因组测序(whole genome sequencing, WGS) , RNA测序(RNA sequencing, RNA-Seq)和中枢神经系统(central nervous system, CNS)肿瘤的甲基化阵列的结果 (图1) 。 92.1%的肿瘤至少具有一种致病性或可能致病性的体细胞突变 , 从而影响关键的致癌、抑癌通路 。 WGS在16.2%的患者中发现了致病性的致癌变异 。 在76例中枢神经系统肿瘤中 , 有71.1%的患者通过甲基化分析确诊 , 有2例(2.6%)患者存在病情与诊断结果的改变 。 染色体1q扩增是所有肿瘤类型中最常见的染色体全臂扩增 , 然而与重复拷贝数变异(copy number variants, CNVs)相比 , 整个染色体臂的扩增或丢失并不常见 , 这与成人肿瘤并不相同 。 可能表明儿童癌症中CNVs的驱动机制不同 。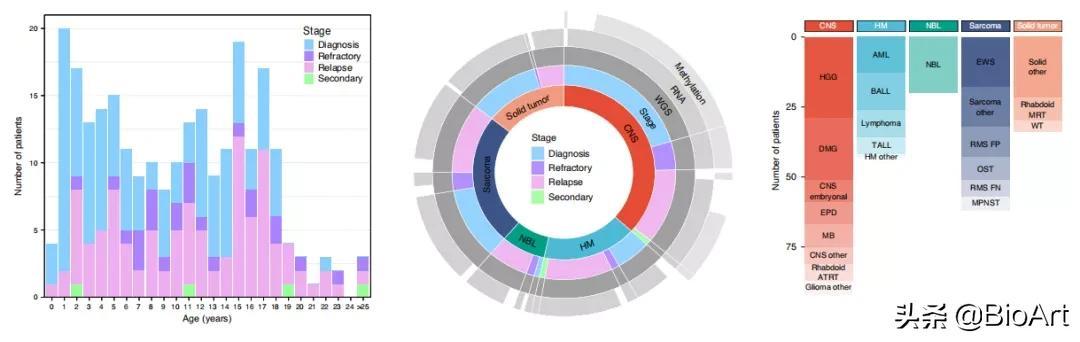 文章插图
文章插图
图1 儿童零癌症计划队列人口统计
与此同时 , 高危儿童癌症往往具有可治疗的基因组特征 。 可用于治疗的单核苷酸位点变异(single-nucleotide variants, SNVs)、拷贝数变异(copy number variants, CNVs)和结构变异是直接或间接指导使用靶向抗癌药物治疗的致病性变异 。 可指导临床作为的变异可以引导病情与诊断结果的改变 , 例如: RTKs点突变(BRAF、ALK、EGFR和FGFR1)、拷贝数增加(PDGFRA、EGFR和ERBB2)或基因融合激活 。 PI3K-mTOR变异包括已知的激活PIK3CA突变, PTEN、PTPN11、PIK3R1、PIK3R2、MTORC1和MTORC2失去功能的突变以及缺失突变 。 生殖系WGS显示癌症易感性基因的生殖系突变率高 , 但令人惊讶的是 , 只有少数患者了解这种家族患病风险 。
- 综述 | Nature Reviews Microbiology:微生物病毒生命规律的再认识
- cas号1037792-44-1_MBX-2982_技术资料MedBio
- 科研 | Nature:果蝇中微生物-肠-脑轴对氨基酸缺乏的反应
- Nature 综述导读:FDA 批准第 100 个抗体药物!抗体药物的研究方向在哪里?
- Nature 最新研究:硬核预防HIV,艾滋病还会是“不治之症”吗?
- 如何提高自身免疫力?《Nature》:试试给T细胞做个“早教”
- Nat Rev Immunol综述: 过继细胞治疗中细胞网络调控T细胞持久性
- 【Nature】连发3篇重磅文章:肠道中的癌症干细胞对邻近细胞产生不良影响
- Nature子刊:以色列科学家找到了延长寿命30%的方法,只需过表达1个基因
- Nature子刊:雪上加霜!肾不好会影响白细胞生物钟,导致心脏病的发生
