强而|乙肝RNAi新药机制,强而特异性基因沉默,受小双链RNA影响
RNAi途径较为明显优势是 , 促使后生物动物细胞中 , 普遍存在的转录后基因沉默(PTGS)机制 。 小番健康再接上一章 , 深入介绍当前用于开发全球慢性乙肝新药常见的RNA干扰(RNAi)和其他靶点有什么不同 。

文章图片
乙肝RNAi新药机制 , 强而特异性基因沉默 , 受小双链RNA影响
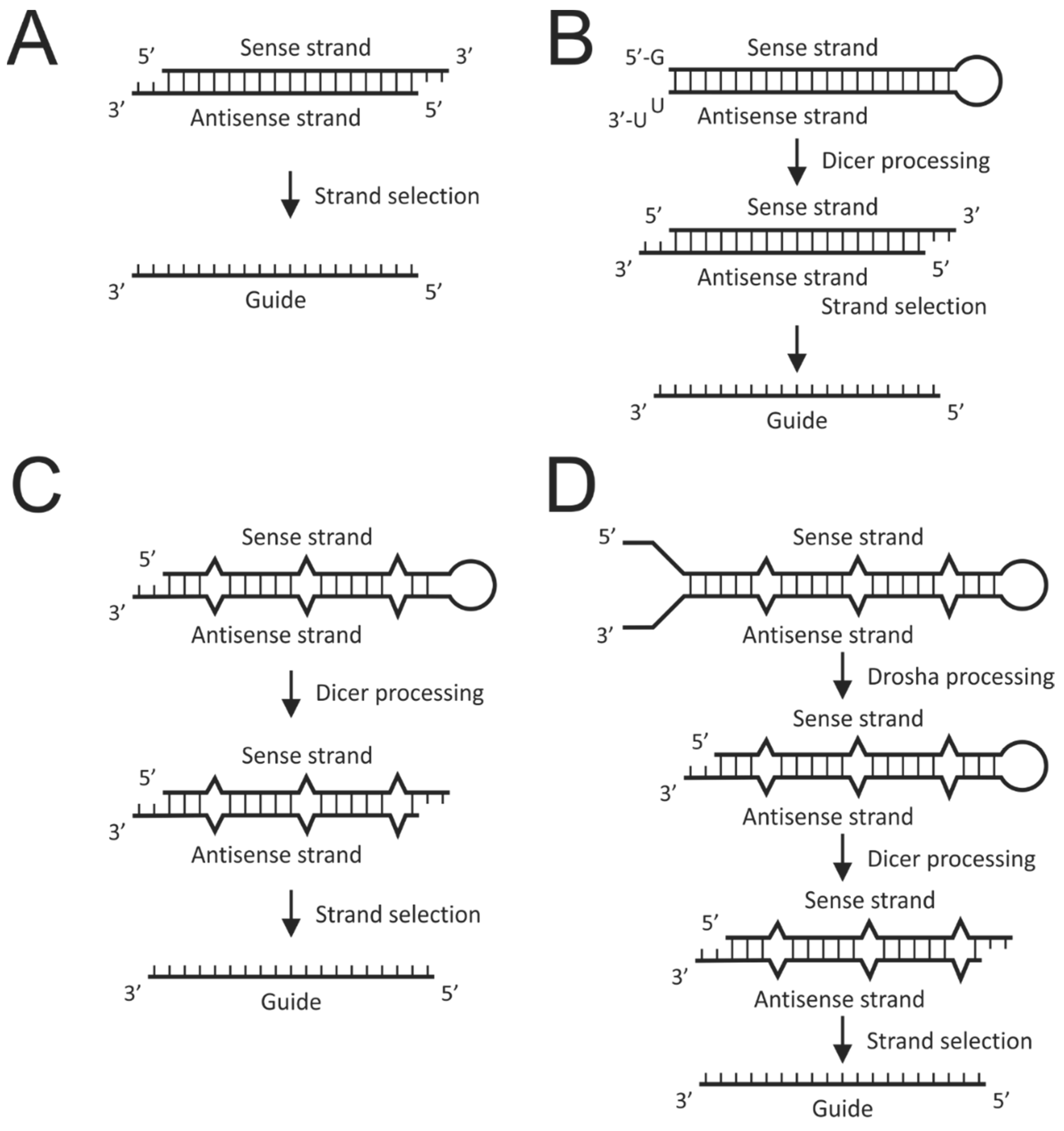
这种途径开发的研究药物 , 强而特异性的基因沉默 , 主要是受到小的双链RNA影响 , 比如 , 21-23nt短干扰RNA(siRNAs)和≈22nt microRNAs(miRNAs) 。 在哺乳动物细胞中 , miRNAs在基因调控中起着基础性作用 , 由miRNA的生物合成途径产生的 。 尽管这一途径的基本步骤是众所周知的 , 但最近已经描述了其额外的调节因子和机制 。
编码miRNAs的基因被转录以产生前体转录物 , 从中可以逐步生成成熟序列 , 包括RNase III酶的作用 。 转录本中的特征性发夹结构 , 构成了原发性miRNA(pri-miRNAs) 。 pri-miRNA中的序列基序 , 被核Drosha–DGCR8微处理器复合体识别 。 产物是一种被称为miRNA前体(pre-miRNA)的较短发夹 , 由Exportin-5以Ran-GTP依赖的方式 , 通过核孔复合体从细胞核中输出(下图——南非约翰内斯堡威特沃特斯兰德大学健康科学学院病理学院抗病毒基因治疗研究室:合成和表达RNA干扰(RNAi)途径激活剂) 。
文章图片
在细胞质中 , 前miRNA的末端环被RNase III酶切开 , 产生一个不完全配对的≈22bp的miRNA双链 。 通过Drosha和Dicer对RNaseⅢ的切割 , 双链末端有2个nt3′悬垂 。 选择miRNA双链的一条链 , 作为成熟的miRNA或引导序列 , 并加载到RNA诱导沉默复合物(RISC)的Argonaute(Ago)蛋白上 。 在转载前 , Dicer与TAR(反式激活反应)RNA结合蛋白(TRBP)结合形成RISC负载复合物 。
RISC负载是不对称的 , 因为选择稳定性较低的miRNA双链作为成熟的miRNA 。 有4种密切相关的Ago蛋白(ago1-4)可能与miRNA相关 , 但只有Ago2具有核酸内切酶的活性 。 miRNA通常将RISC引导至信使RNA(MRNA)3′非翻译区(UTR)的部分互补结合位点 , 然后将其靶向翻译抑制、去基化和降解 。 或者是 , 如果miRNA和mRNA之间 , 存在近乎完美的互补碱基配对 , 那么 , mRNA可能被Ago2 RISC切割 。
文章图片
这份关于RNA干扰(RNAi)开发全球乙肝新药的技术 , 经常发生在人工RNAi激活剂中 , 当然 , 这种激活剂现已经被全球众多药企用于开发抗HBV新药 。 这些人工序列被设计成在miRNA生物合成途径的不同步骤中 , 作为中间产物来重编程沉默以用于慢性乙肝 。 与天然的中间产物一样 , RNA激活剂的序列和结特征 , 对于实现高效的HBV基因沉默具有重要的意义 。

文章图片
【强而|乙肝RNAi新药机制,强而特异性基因沉默,受小双链RNA影响】小番健康结语:RNAi途径开发新药十分复杂 , 作用机制也与其他靶标明显存在差异性 , 但已被全球科研人员证明是一种高效沉默乙肝全病毒基因型的潜在治疗方法 。 通过深入对RNA干扰在HBV药物开发的作用机制认识 , 我们也能够发现RNAi与核苷酸逆转录酶抑制剂(恩替卡韦或替诺福韦)的开发原理截然不同 , 全球肝病学领域科研人员 , 通过以抑制乙肝病毒生命周期更多不同步骤 , 来达到更理想的终点(2020年8月4日 Viruses) 。
- 新药|乙肝在研新药ABI-H0731,II期211研究,安全性数据
- 研究|乙肝在研新药2种化合物,小鼠模型,组合或联合抗HBV药物价值
- 药物|乙肝重新认识,NA抑制新cccDNA形成,1种新药进入3期
- 古巴|乙肝在研新药NASVAC,日本古巴科学家开发,鼻腔给药改良版
- 测量|乙肝现实目标,彻底清除或需联药,测量肝内cccDNA是难点
- 应用|乙肝新药开发应用,基于抑制cccDNA形成,RNAi理论基础
- 新药|乙肝在研新药AB-729,I期单剂量12周,表面抗原持续下降
- cccDNA|乙肝在研新药RNAi激活剂,成功检测已有3种,阻止转录物翻译
- 日本|乙肝HCC靶点潜力,日本科学家发现,miRNA调参多基因表达
