「RCC文献月评-9」专家领读肾癌领域最新文献及研究进展( 四 )
图2. 疾病进展的累积发生率(pCIP5y)
优化的HDACI和TKI组合可有效抑制肾细胞癌代谢并克服舒尼替尼耐药
摘要:透明细胞肾细胞癌(ccRCC)具有高组蛋白去乙酰酶(HDAC)活性的特征 , 可促进肿瘤转移 。 因此需要建立新的治疗策略以促进HDAC抑制剂(HDACIs)应用 。 作者应用“治疗指导的多药优化(TGMO)“技术进行一系列TKIs与HDACIs组合测试 , 最终确定了一种可使转移性ccRCC 细胞 , Caki-1细胞的代谢活性降低了80%以上的低剂量三联用药方案(优化药物组合 , ODC) 。 ODC可诱导亲代Caki-1细胞和舒尼替尼耐药的Caki-1细胞凋亡 , 并显示出抗血管生成活性 。 根据磷酸化蛋白质组学分析结果 , 作者发现加入其他靶向作用于该细胞系高转录、高磷酸化靶标的药物可增强ODC作用 。 这些数据表明 , 优化的低剂量药物组合在复杂的体外环境下非常有效 , 并能增强HDACIs的活性 。
专家点评
晚期肾癌系统化治疗药物层出不穷 , 但几乎所有药物在使用一定时间后均会出现药物抵抗 , 延缓甚至避免耐药发生的临床策略包括有效药物的合理序贯治疗、不同药物的联合治疗以及新药研发 。 本项研究利用TGMO技术快速寻找协同有效的用药组合 , 同时根据磷酸化蛋白组学及RNA测序等方法 , 特异性分析不同细胞的靶标表达及磷酸化水平 , 从而该药物组合方案的个体化治疗 , 为未来精准治疗提供了的分选手段 。 HDAC抑制剂的使用在非免疫原性/驱动基因的肾细胞癌的临床治疗价值尤其重要 , 国外正在进行HDAC抑制剂治疗肾癌的相关临床试验 。 结合本研究的信息 , 我们也期待HDAC抑制剂联合治疗在延缓耐药 , 延长生存获益方面的前景 。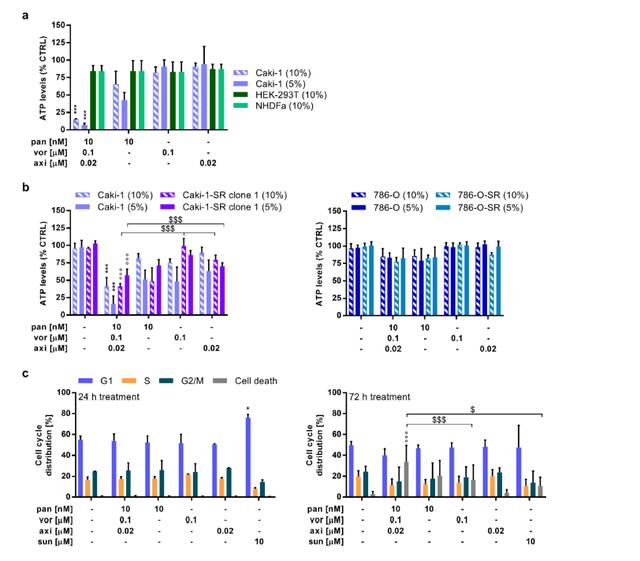 文章插图
文章插图
图1、对优化药物组合(ODC)活性进行评估:选择性分布、克服舒尼替尼获得性耐药的疗效和诱导细胞凋亡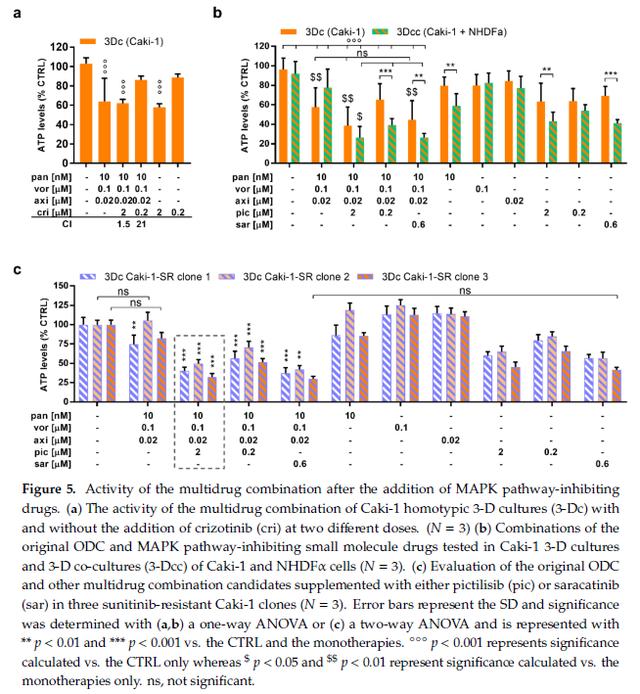 文章插图
文章插图
图2.添加MAPK信号途径抑制药物后多药组合的活性
仑伐替尼联合依维莫司治疗转移性肾细胞癌患者的2期临床试验中相关血清标志物分析
背景:目前尚无生物标志物可预测肾细胞癌(RCC)的疗效 。 在一项II期研究的探索性回顾分析中 , 作者构建了复合生物标志物评分(CBSs)系统以预测接受仑伐替尼联合依维莫司治疗(联合治疗)的转移性RCC患者的无进展生存(PFS)和总生存(OS) 。
方法:在检测的40个生物标志物中 , 分别选取5个与PFS或OS相关性最强的生物标志物建立PFS-CBS (HGF、MIG、IL-18BP、IL-18、ANG-2) 及OS-CBS (TIMP-1、M-CSF、IL-18BP、ANG-2、VEGF) 。 应用PFS-CBS和OS-CBS共有的生物标志物建立2因素CBS 。 5因素CBS高分组:3-5 , 低分组:0-3;2因素CBS高分组:1-2 , 低分组:0 。
结果:5因素CBS高分组患者接受联合治疗的PFS/OS显著优于低分组(P=0.0022/P<0.0001) 。 5因素CBS高分组患者中 , 接受联合治疗的PFS/OS较依维莫司单药治疗显著延长 (P<0.001/P=0.0079) , PFS较仑伐替尼单药治疗也显著延长(P=0.0046) 。 多因素分析显示5因素CBS和2因素CBS可预测不同治疗方案的PFS和OS (指仑伐替尼联合依维莫司 vs. 依维莫司) 。
结论:5因素-CBS可识别能从仑伐替尼联合依维莫司治疗中获益的转移性RCC患者 , 但这一结果仍需进一步验证 。
专家点评
Voss教授团队早在2016年即对RECORD-3研究患者的血清标志物与药物疗效的相关性进行了分析 , 并发现了IL-18的血清表达水平与SUNITINIB或EVEROLIMUS疗效相关 。 2020年BJC再次报道了Voss教授团队针对EVEROLIMUS联合PEMBROLIZUMAB作为晚期肾癌二线治疗的2期临床研究进行的类似研究 。 该研究除了再次证实IL-18的低表达与更好的联合治疗疗效相关外 , 还发现HGF, MIG, 及ANG-2等其他4种分子标记物的疗效预测价值 , 并据此建立了5因素和2因素的血清标志物预测模型 , 有效预测了EVE+PEMBRO联合治疗的优势人群 。 研究结果充分显示了血清相关标志物的检测对靶向治疗或免疫治疗有效人群的有效分选 , 希望在建立血清标志物预测模型的基础上 , 能够实现临床检测的可及性 , 最终产生临床治疗决策切实可行的指导价值 。
- 植物乳杆菌Lp299v的循证文献合集
- 小孩为什么会聋?
- 网站 | 适合医学临床科研的文献数据库,国内外都有哇
- 文献精读 | TLR4-MyD88信号通路参与子宫内膜异位症相关疼痛的发生发展
- 2021年4月编译光荣榜丨血管资讯“文献编译”人气Top10公布!
- 经典高分文献阅读·葡萄牙老年患者术前认知能力、局部脑氧饱和度和术后谵妄的相关性
- 中医药治疗软骨疾病近20年文献知识图谱分析
- 辣椒可以治疗癌症吗?翻阅文献,没想到辣椒还有这么多作用
- Castleman 病六例报道并文献复习
- 这篇论文引用了300余篇文献,无可辩驳地证实了中草药对阿霉素心肌炎的确凿疗效
