骨质疏松症的新型疗法——合成代谢药物
 文章插图
文章插图
本文重点
?骨吸收抑制药物如双膦酸盐 , 一直是治疗骨质疏松症的主要手段 , 但因其不良反应而导致患者依从性降低;
?合成代谢药物是通过促进骨形成来改善骨质量的新方法;
?可单用或与骨吸收抑制药物联合应用的合成代谢药物有望带来新的临床模式 。
一直以来 , 治疗骨质疏松症的主要药物是骨吸收抑制药物(如双膦酸盐) , 持续服用有效降低骨折风险 。 然而 , 由于该药存在的不良反应导致患者依从性降低 。 因此 , 随着骨吸收抑制药物使用率的下降 , 髋骨骨折率的降低已经趋于平缓状态 。 在过去二十年里 , 一种新型的通过促进骨骼形成来改善骨质量的合成代谢药物(包括三种新药)得以批准 。 该疗法有望带来一种新型临床模式 , 既可单用 , 也可与骨吸收抑制药物联合应用以促进骨骼形成并降低骨折风险 。
近日 , 发表在Nature Reviews Endocrinology(IF:21.076)的一篇综述归纳总结了关于合成代谢疗法在骨质疏松症治疗方面相对有效性的见解 , 主要讨论合成代谢药物与其他疗法的对比疗效 , 以期更好地指导其未来的临床应用 。
什么是骨质疏松症?
骨质疏松症是一种以骨量减低、骨组织微结构损坏 , 导致骨脆性增加、易发生骨折为特征的全身性骨病 。 2001年美国国立卫生研究院( National Institutes of Health , NIH)指出骨质疏松是以骨强度下降和骨折风险增加为特征的骨骼疾病 , 骨强度涵盖骨量和骨质量两大要素 。 骨质疏松是一种与增龄相关的骨骼疾病 , 随着年龄增长发病率增高 。 据统计 , 仅在美国就有1000万人患病 , 其中最主要影响50岁以上的女性 。 骨质减少是骨质疏松的前期表现 , 同时可增加未来的骨折风险[1] 。
*骨密度(BMD)测试结果称“T值” , 世界卫生组织(WHO)定义如下图:
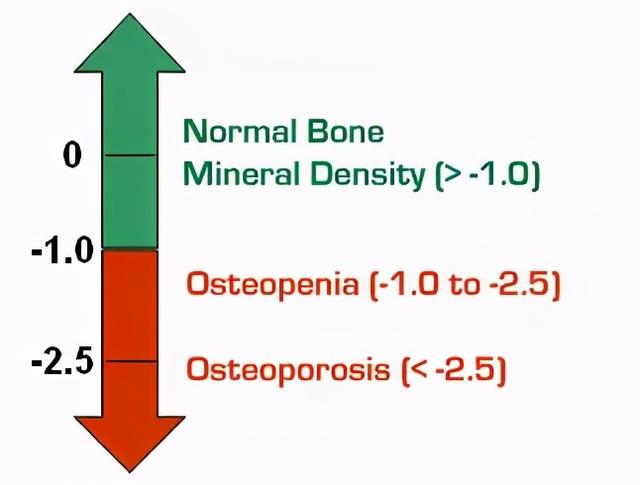 文章插图
文章插图
 文章插图
文章插图
在成年人中 , BMD是骨折风险的替代指标 , 反映了青春期峰值骨量和成年后平衡重建骨骼的维持量之和 。 成人有数百万个基本的骨重建单位 , 每年有10%的骨骼在这些单位重建 , 首先是通过诱导吸收 , 然后是逆转阶段 , 最后是新骨骼的形成 。 而与年龄相关的骨骼丢失主要是由组织水平的骨重塑增加和有利于加速再吸收和/或损伤形成的重塑失衡所致[2] 。
那么 , 正常骨质到严重骨质疏松的过程到底经历了怎样的变化呢 , 如下图
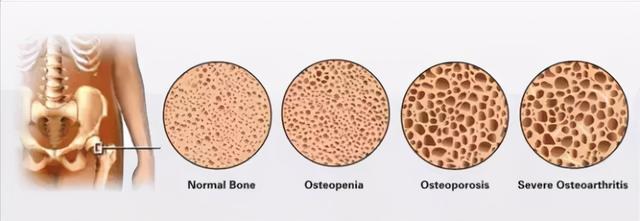 文章插图
文章插图
(正常骨质→骨密度低下→骨质疏松→严重骨质疏松)
骨折会显著降低活动能力和生活质量而导致继发性骨折 , 最终增加死亡率 。 随着全球人口老龄化 , 大多数人出现难以避免的骨质流失 , 本世纪主要临床挑战将在于预防这类骨折 。
在过去四十年里 , 以减少骨吸收为主要目的的疗法已证明可以降低骨折风险并使骨密度增加 。 这些药物不会促进骨形成 , 但可通过抑制破骨细胞的吸收活性来促进BMD的相对增加 , 从而增加重塑空间的填充和骨基质的矿化 。 骨吸收抑制药物(antiresorptive agents , ARA)主要包括双膦酸盐类如如伊班膦酸盐、利塞膦酸盐、阿仑膦酸盐和唑来膦酸 , 其作用主要通过抑制FPP合成酶(farnesyl pyrophosphate synthase)来实现 , FPP合成酶是胆固醇生物合成途径中促进破骨细胞吸收的关键酶 。
由于在基质中的半衰期很长 , 因此ARA能够很好地促进骨密度的长期增长 , 但同时也会带来不利骨骼影响的风险 。
- 患者|同济大学附属同济医院与蚌埠三院麻醉科联合举办“超声引导下新型连续神经阻滞麻醉及镇痛技术”培训班
- 超2亿美元合作 辉瑞/Dewpoint共同开发DM1潜在疗法
- 癌细胞“清零”!大爷胃癌晚期,无法手术,依靠免疫疗法重获新生
- 盈浦街道:真方便!家门口也能做“雾化治疗”
- 肿瘤免疫疗法靶向药物是什么?肿瘤免疫疗法好在哪里呢?
- 喜讯!江西省儿童医院护士吴小青获得国家实用新型专利
- 痛风的“自然疗法”,安全又有效,你了解吗
- 新型口服抗凝药是否真的无需检测?“药师来了”第三期来袭,戳我预约→
- 2型糖尿病案例分析:肠道菌群疗法5天,空腹血糖从13降到7
- 肌内效贴疗法,您了解吗?
