研究重点
即使串联移植,MRD阴性的多发性骨髓瘤患者仍中有高达39%的患者可发生MRD转阳,而这正预示着未来疾病会复发;
如果诊断后较短期内发生MRD转阳,会导致OS和PFS变差。
随着新药的面世,越来越多的多发性骨髓瘤(MM)患者可在治疗后可达到骨髓微小残留病(MRD)阴性,获得MRD阴性对于新诊断MM患者一般意味着PFS和OS更优。但多发性骨髓瘤仍是无法治愈的疾病,很多医生也在临床中观察到MRD阴性状态丢失(loss of MRD negativity),即MRD转换(conversion)。
当前的IMWG标准中,关于复发的标准也未纳入MRD阴性丢失作为进展的影响因素。并且,MRD由阴性转为阳性的意义,目前也尚无定论
为了确定MRD转换的发生率,以及它对临床预后的启示,来自阿肯色大学医学院(小石城)骨髓瘤中心的Maurizio Zangari教授牵头了一项研究,他们分析了568例达到骨髓MRD阴性的患者(自体干细胞移植联合免疫调节剂和蛋白酶体抑制剂的多药维持治疗后,且高达80%为串联移植)并进行随访。发现39%的患者在治疗后中位6.3年发生MRD转换;MRD转换与高复发风险相关;前3年内MRD转换患者的总生存期和无进展生存期劣于持续MRD阴性患者;并且MRD转换可准确预测70%的临床复发,证明连续骨髓MRD监测可作为标准实验室/影像学检查的补充,从而做出可靠的挽救治疗决策。
患者选择
作者选择了他们医疗中心连续的568例新诊断多发性骨髓瘤患者,患者均在移植和维持治疗后获得了≥VGPR缓解和骨髓MRD阴性(间隔3个月以上的连续2次检测),同时PET-CT和/或MRI DWIBS也为阴性,后者的目的是确保研究仅纳入深度缓解患者,排除局部病灶无法检测的患者。
患者的一线治疗为包括IMiD和PI的多药诱导方案,随后大剂量化疗、自体干细胞移植(ASCT)联合IMiD和PI维持治疗至少2年。100%的患者接受了至少1次ASCT,80%接受了串联(tandem)ASCT。
MRD评估
作者从2010年起,在临床实践中均常规使用流式连续检测骨髓MRD状态,而不考虑患者IMWG缓解状态。骨髓MRD多色流式细胞术评估的时间为治疗前、移植前、移植后2年内每3-6个月、随后6-12个月取决于患者是否仍在维持治疗,每位患者MRD评估的中位次数为15。
作者使用的骨髓穿刺MRD评估手段为8色二代流式细胞术,最低灵敏度10-5 细胞。MRD阴性丢失定义为105个成核细胞中检测到≥1个恶性浆细胞。
风险分层和复发标准
根据诊断或本院就诊时的基因表达谱(GEP)进行风险分层,低危和高危分别定义为GEP 70风险评分<0.66和大于等于0.66;还根据R-ISS评分评估风险;缓解和复发的评估标准为IMWG。作者使用流式细胞术测定的异常浆细胞与正常浆细胞的比值>0.2作为临界值,用以统计复发风险。
生化复发定义为出现下列所有情形的复发:M蛋白或血清游离轻链升高,骨髓浆细胞少于30%,PET-CT扫描和/或MRI未发现新的局灶性病变,无CRAB标准,复发时无高危GEP,无MM相关的分裂中期细胞遗传学异常(abnormal metaphase cytogenetic abnormalities)。
临床复发定义为出现任何下列情形的复发:BM受累超过30%、影像学(PET-CT、MRI DWIBS)显示存在新的局灶性病变、存在CRAB标准之一、复发时存在高风险GEP签名或与MM相关的分裂中期细胞遗传学异常。
MRD转换复发定义为,初始MRD阴性后,105个成核细胞中检测到≥1个恶性浆细胞。
结果
MRD转换的风险在前5年内最高,并持续至诊断后15年
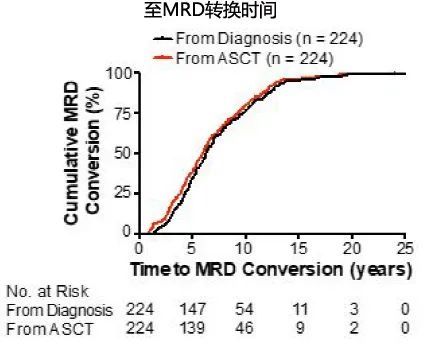
共568例患者获得MRD阴性(检测至少2次,间隔3个月),时间为启动治疗后中位2.4年。从诊断开始计算,患者中位随访9.9年,61% (344/568)的患者维持MRD阴性,而另外39%的患者发生了MRD转换,既阴性转换到阳性,从启动治疗计算的中位至MRD转换时间为6.3年,如果从ASCT开始计算则为6年;MRD转换的患者中,大部分(76%, 170/224)发生于MM诊断的10年内。如图。
文章插图
此外,与诊断后5-10年、>10年和>15年相比,诊断后5年内MRD阴性丢失的风险更高。
基线期细胞遗传学异常和GEP 70与MRD转换的关系
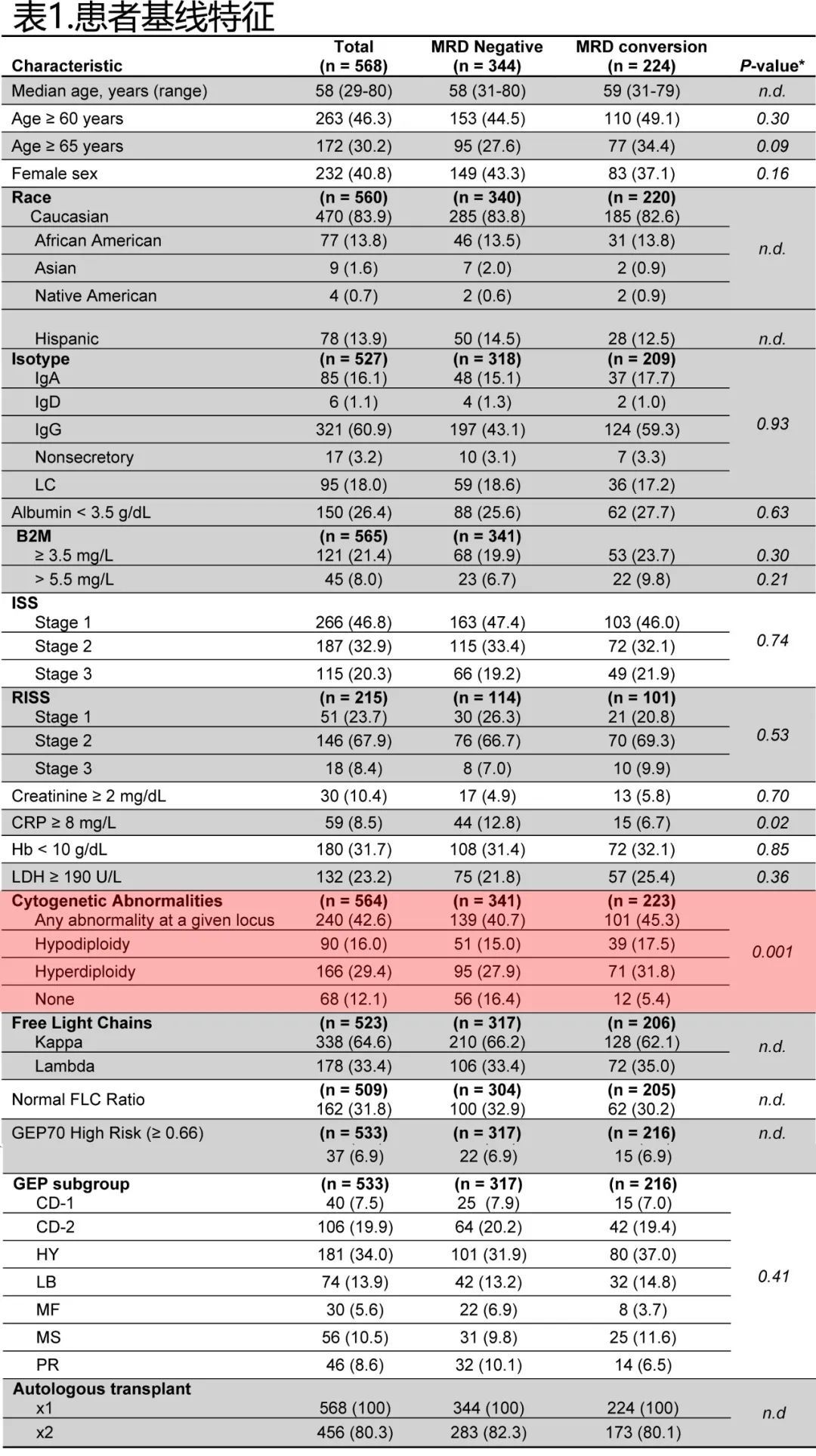
全部队列患者与MRD转换、维持MRD阴性患者的基线特征如下。
文章插图
患者中位诊断年龄为58岁,且年龄≥60岁或≥65岁均未明显影响MRD阴性率(45%, 153/344 vs. 49%, 110/224; P = 0.30)或转换率(28%, 95/344 vs. 34%,77/224; P = 0.09)。但诊断时如果存在异常的分裂中期细胞遗传学异常,则MRD转换率明显更高(95%, 211/223 vs. 84%,285/341; P = 0.001; 表1; 图2)。其他因素多数不影响MRD转换风险,包括ISS和R-ISS分期。
- 医保|创新药实现医保报销 助力多发性骨髓瘤慢病化
- 多发性|宫氏话健康丨多发性硬化症,女性发病率比男性高一倍
- 多发性骨髓瘤|浅谈多发性骨髓瘤的规范化治疗
- 多发性|永州市中心医院成功开展全市首例感觉诱发电位检查
- 肾功能|腰腿疼须警惕多发性骨髓瘤
- 多发性|一月注射一次,多发性硬化新药获批上市
- 奥法妥木单抗获批,多发性硬化治疗进入精准治疗时代|健康 | 硬化
- 血液科|出现不明原因腰腿痛应重视 江苏省中医院专家成功控制多发性骨髓瘤患者病情
- 手游|幻书启示录宣布关服,绊爱无限期停止活动 | 二次元周报
- 多发性肌炎|体内有癌,手脚知道?四肢出现4个异常,警惕肺癌来敲门
