进程|荣昌生物-B:2款核心产品递交新药上市申请,商业化进程加快( 二 )
在美国,泰它西普已于2020年1月获得FDA的同意开展用于治疗SLE的美国注册性临床试验,并在今年4月被授予快速通道资格。荣昌生物计划将于2021年上半年开展全球 SLE的3期临床试验,包括美国、欧洲及其他国家地区。
Disitamab vedotin:国内首个提交上市申请的ADC药物
抗体偶联药物(Antibody-Drug Conjugate,ADC)是通过连接子(linker)将具有生物活性的小分子药物偶联至单克隆抗体上而产生的,从而同时发挥抗体高特异性与细胞毒小分子的高毒性,利用抗体-抗原的高度靶向结合将药物输送至肿瘤部位,发挥杀伤肿瘤细胞的作用。
2000年第一个ADC药物Mylotarg上市,成为第一代ADC药物。随着ADC药物技术的成熟,随后的七八年FDA批准了三个ADC药物,2019年一年甚至连续批准3个ADC药物上市,这也使得更多的药企参与到ADC药物的研发当中。根据Cortellis数据统计显示,截止2020年Q1,全球处于研发状态的ADC药物共计311个,其中临床II期和III期的研发管线有33个,处于注册前以及已上市的有9个。
图表三:ADC类药物结构示意图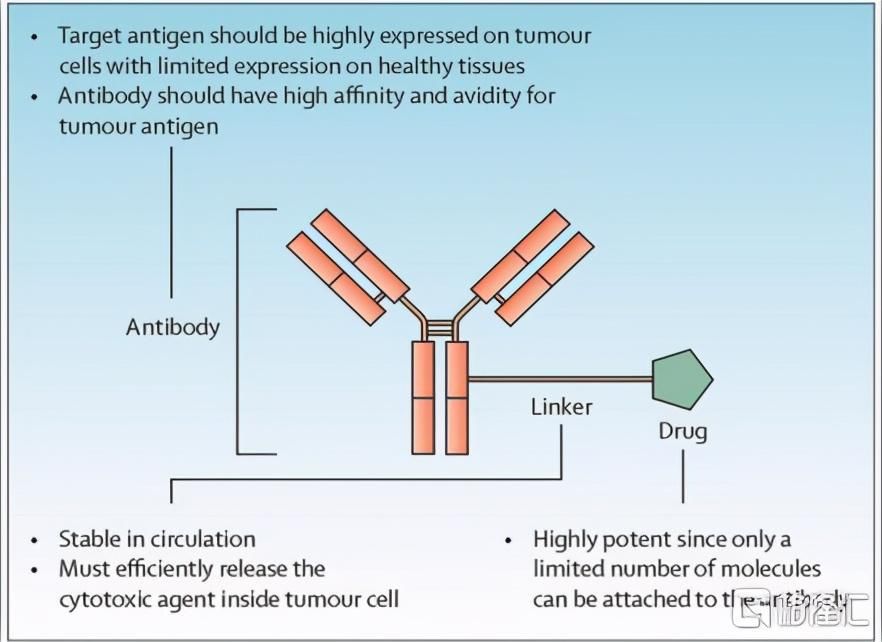
文章插图
数据来源:Anish Thomas等《Antibody-drug conjugates for cancer therapy》,格隆汇整理
凭借着ADC药物适应症广泛、高效、低毒等特点,仅目前获批适应症就有望每年在中国创造超过30亿的市场(数据来自财通证券)。此外,ADC类抗体药物与单抗类药物一样,具有平台属性,可以随着靶点、抗体技术的提升,不断扩展其他肿瘤的适应症以及其他疾病领域的治疗。
从目前竞争情况上来看,荣昌生物在国内ADC领域拔得头筹。根据CDE数据统计显示,在国内ADC的临床进度中,仅有荣昌生物的Disitamab vedotin已经处于NDA阶段,成为国内首个提交上市申请的ADC企业,进度远超于其他同类竞争药企。
图表四:国内部分HER2-ADC临床开发进展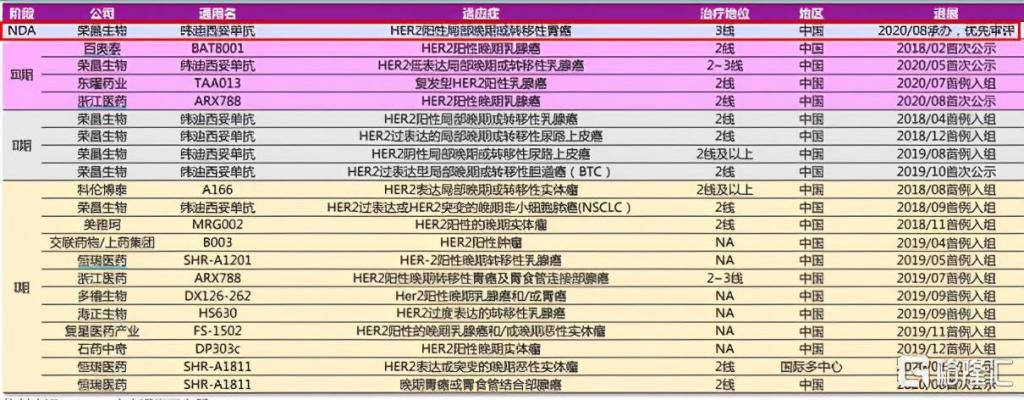
文章插图
数据来源:CDE,光大证券,格隆汇整理
Disitamab vedotin是处于后期临床阶段的抗HER2抗体药物偶联物(ADC),是中国首款申请上市的自主创新ADC药物。
荣昌生物正在开发disitamab vedotin用于治疗目前尚缺乏治疗手段的常见HER2表达适应症,包括乳腺癌以外的HER2表达(IHC 1+或以上)癌症适应症,例如胃癌(GC)和尿路上皮癌(UC)(目前均在中国进行注册性临床试验),以及HER2低表达的癌症(IHC 2+/FISH-或IHC 1+)适应症,例如HER2低表达的乳腺癌(目前在中国进行注册性临床试验)。
在针对胃癌的及尿路上皮癌的临床研究中,disitamab vedotin已表现出优异的抗肿瘤活性和良好耐受性:
(1)截至2020年6月22日,在胃癌的2期注册性临床试验中,对于127名曾接受过二线化疗治疗的HER2过表达(IHC 2+或IHC 3+)GC或GEJ癌症患者,disitamab vedotin的客观缓解率(ORR)为24.4%(经独立评审委员会(IRC)评估确认),无进展生存期(PFS)中位数为4.1个月,总生存期(OS)中位数为7.6个月。
- 吴王刘濞为何要联合其他六国反叛汉朝?晁错只是加快这个进程而已
- 这种野生物,若遇到请你高抬贵手将其放走,别抱去卖钱,很是珍贵
- 入春进程再度受阻 冬季连阴雨上线
- 解放牛的工作,是人类文明发展的重要进程
- 刘秀|历史上唯一一个,覆灭二十年后再次复兴的王朝,繁荣昌盛近200年!
- 时期|三国令人惋惜的6个人郭嘉孙坚在内,每位都能改写历史进程
- 明朝|明朝武器的先进程度,让清朝多花300年都造不出来
- 明朝火器有多牛?先进程度曾惊艳世界,清朝却一件都造不出来
- 妙计|吴三桂手下第一谋士刘玄初:一条妙计差点灭掉清朝改变历史进程
- 楚汉之争|若是在楚汉之争中项羽打败了刘邦,历史进程会如何变化
