急性肾损伤:未得到重视的糖尿病并发症( 二 )
 文章插图
文章插图
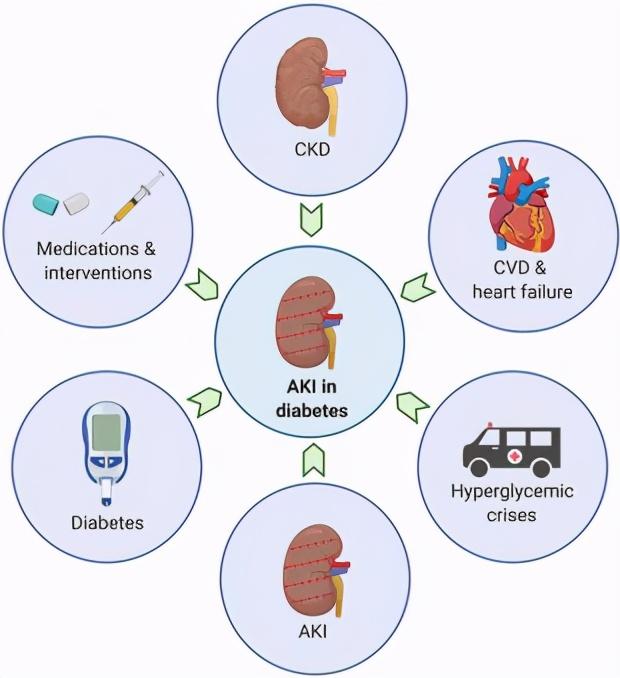
01、慢性肾脏疾病增加AKI的风险
糖尿病是全球造成慢性肾脏疾病(CKD)最常见的原因 。 截至2016年 , 全球CKD患病率为3732例/10万人 , 其中 , 每100 000人中有1691例可归因于糖尿病 。 反过来 , CKD独立地增加了AKI的风险 。
02、心血管疾病和心力衰竭增加AKI风险
糖尿病也会增加心血管疾病(CVD)和心力衰竭的风险 , 这些情况本身也会增加AKI的风险 。 约40%的心脏手术患者同时患有糖尿病 , 根据所研究的人群 , 心脏手术相关AKI的报告发病率差异很大 , 在5%~42% 。 接受CABG的患者中 , 26%的心力衰竭患者发生AKI , 这本身在糖尿病患者中更常见 。 冠心病(CAD)患者在进行稳定的CAD或治疗急性冠状动脉综合征时 , 可能会接触造影剂 。 在回顾性分析中 。 接受经皮冠状动脉介入治疗的2000例患者中 , AKI发生率为2.3% , 需要肾替代治疗发生率为0.3% 。
03、高糖危机引发AKI
除了糖尿病的长期并发症外 , 糖尿病的急性高血糖并发症 , 即糖尿病酮症酸中毒(DKA)或高渗高血糖状态(HHS)也会增加AKI的风险 。 在一项回顾性研究中 , 94例被送进重症监护病房的严重DKA患者中有47例(50%)在入院时出现AKI 。 在一项针对165例接受DKA治疗的1型糖尿病儿童的单独研究中 , 106例(64.2%)患有AKI , 其中两例需要血液透析 。 在HHS患者中 , AKI的发生率还没有得到明确的统计 , 然而 , HHS往往表现为重度脱水和横纹肌溶解 , 这本身也增加AKI的发生率 。
04、AKI本身增加AKI的风险
除了糖尿病急慢性并发症对AKI发生风险的贡献外 , AKI本身也增加了AKI未来发生的风险 。 例如 , 在一项对11 863例AKI住院患者的研究中 , 2954例患者(25%)在出院后12个月内因复发性AKI住院 。 同样 , 在一项对38 659例北加州住院患者的回顾性队列研究中 , 11 048例患者在第一次住院后的0.6年经历了二次住院 , 并伴有AKI 。 在AKI发作后 , 可能有几个原因导致未来AKI的风险增加 。 一方面 , 在个体中发生AKI , 根据定义 , 该个体被认定为AKI高风险者 。 另一方面 , 也有来自细胞层面的解释 。 例如 , 表观遗传学解释:短暂的环境损伤可以导致持续的细胞变化 , 表观遗传过程近来被认为是AKI和肾脏修复的重要参与者 。
05、用于治疗糖尿病的药物可能增加也可能降低AKI风险
肾素-血管紧张素酮系统(RAAS)阻滞剂通常用于高血压的治疗 , 血管保护并减缓糖尿病患者肾脏疾病的进展 。 在肾灌注减少的时候 , 如低血容量或肾动脉狭窄 , RAAS阻断剂可能通过优先扩张出球小动脉血管来降低肾小球内压力来促进AKI的发展 。 然而 , 支持RAAS阻断剂作为AKI发展中的致病因素的证据出奇的少 。 在一项来自英国临床实践研究Datalink(CPRD)的队列研究中 , 570 445例受试者(303 761例使用ACEIs或ARBs)的中位随访为4.1年 , 调整后的AKI相对HR仅为1.12(95%CI:1.07~1.18) 。
也有人担心使用钠-葡萄糖共转运蛋白2(SGLT2)抑制剂的风险 , 但目前的证据都很正向:SGLT2抑制剂似乎与AKI事件的减少呈正相关 。 这种AKI风险的下降已在三个单独的Meta分析中得到证实(HR=0.66 , 95%CI:0.54~0.80;OR=0.64 , 95%CI:0.53~0.78;RR=0.59 , 95%CI:0.39~0.89) 。 同样 , 在对两个队列的倾向匹配分析中 , 研究人员发现2型糖尿病患者使用SGLT2 抑制剂的AKI风险没有增加 , 并且有降低的趋势 。 即使在针对AKI高风险的个体的随机对照试验中 , SGLT2抑制也没有被发现与AKI的风险增加有关 。
总之 , AKI在糖尿病中的发病率增加不能简单地归因于在病程中使用可能对肾脏有害的药物 。
06、糖尿病本身增加了AKI的风险
最后 , 糖尿病本身增加了AKI的风险 。 这已经在体外实验模型中得到了证明 。 在一项值得注意的研究中 , 链脲佐菌素诱导的糖尿病或AKI小鼠中 , 糖尿病小鼠对缺血再灌注损伤(IRI)引起的小管细胞损伤和程序性细胞死亡反应更强 。 在同一研究中 , 暴露于高糖的近端小管细胞在ATP耗竭或暴露于严重缺氧后表现出更高的凋亡 。 最终 , 作者确定了以线粒体Bax积累和细胞色素C释放为特征的凋亡内在途径的激活 。 研究者利用化学抑制研究、短干扰RNA和细胞特异性敲除小鼠 , 将细胞凋亡内在途径的激活归因于高糖和缺血损伤的小管细胞p53的上调 , 研究者当时推测这可能是由于抗凋亡的BCL-2以及抗纤维化和促再生的骨形态发生蛋白-7(BMP-7)的下调所致 。 在一项单独的研究中 , 研究人员报告说 , 2型糖尿病db/db小鼠在双侧IRI反应中表现出增强的肾脏损伤 , 伴随着肿瘤坏死因子-a(TNF-a)和Toll样受体4(TLR4) 的上调 。 这些研究指出了凋亡或炎症途径在增加糖尿病AKI 倾向中的作用 。 此外其他机制也可能作出贡献 。 例如 , 使用血氧水平依赖的MRI研究报告了糖尿病患者肾脏的氧合减少 , 这可能至少部分是通过减少肾周围毛细血管数量和密度来介导的 。
- 经常口干眼干?皮肤干痒?专家:警惕干燥综合征,可致多脏器损伤
- 岩莴苣,见过吗?益气,强筋骨。主治劳伤咳嗽、筋骨损伤、刀伤
- 过年过节“急性胰腺炎”是高发期,一定要注意
- 25岁“小魔仙”心梗去世!急性心梗“高能”预警信号千万要抓住
- 岩笋,见过吗?活血祛瘀,接骨。用于骨折、跌打损伤、创伤
- 酒精代谢对肝脏有什么损伤?如何防治保护肝脏健康
- 简单三步丨及早诊治急性间质性肾炎(AIN)
- 从3方面预防可阻止急性肾损伤进展至尿毒症
- 氧化应激失衡在慢性阻塞性肺疾病急性加重期中的作用
- 七氟烷预处理对风湿性心脏瓣膜病患者术后心肌损伤的影响
