ACR速递 | AS患者:控制症状外,如何应对骨的进展?( 二 )
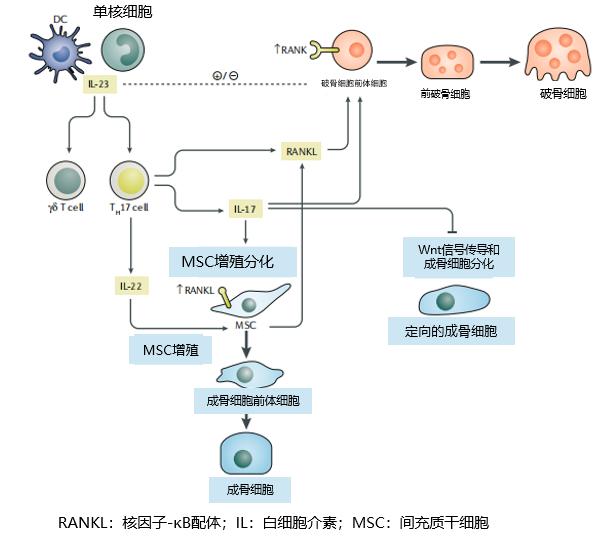
实际上 , 现有研究表明 , IL-23/IL-17通路参与成骨细胞和破骨细胞的分化和功能调节 , 介导了AS中骨稳态失衡所导致的进行性、全身性骨质流失以及局部新骨形成(图1)[11]:
● IL-17:
a. 对破骨细胞:诱导破骨细胞中RANKL表达或直接作用于破骨细胞 , 促进其分化和生成;发挥自身促炎作用 , 增加骨吸收 。
【ACR速递 | AS患者:控制症状外,如何应对骨的进展?】b. 对成骨细胞:诱导间充质干细胞分化为成骨细胞[10] 。
● IL-23:
a. 对破骨细胞:作用仍存在争议——有研究认为 , IL-23既可通过诱导Th17细胞极化和IIL-17生成来诱导破骨细胞分化、也可能直接促进破骨细胞分化 , 但目前缺乏直接证据[12-16];而另有研究认为 , IL-23对破骨细胞有直接抑制作用 , 在稳定状态下对骨骼具有保护作用[17-18] 。
b. 对成骨细胞:无影响 , 间充质细胞和成骨细胞虽然表达IL-17RA , 但不表达IL-23R 。
 文章插图
文章插图
图1:IL-23/IL-17通路参与成骨细胞和破骨细胞的分化和功能调节
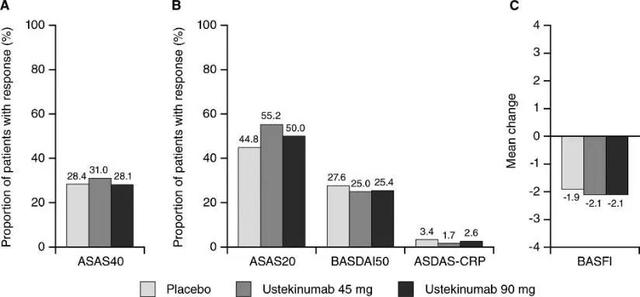
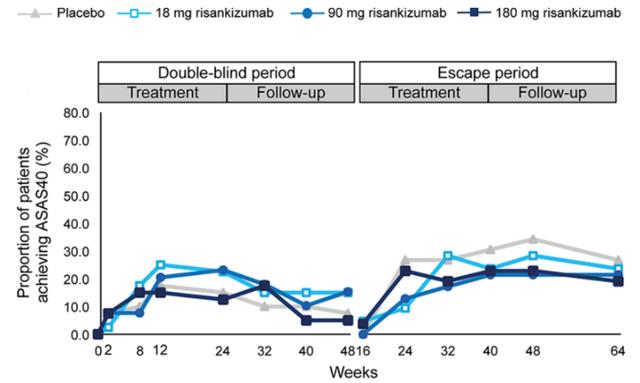
但靶向IL-23的治疗方案却在AS的治疗中缺乏疗效:Atul Deodhar等人的研究显示IL-12/IL-23p40抑制剂乌司奴单抗在axSpA的治疗中无显著效果(图2)[19];而针对IL-23 p19亚基的抗体Risankizumab在一项治疗AS的临床II期试验中并没有达到研究的主要终点——ASAS40应答率(图3) , 无证据表明其与安慰剂组相比有临床意义的改善[20] 。 这表明 , IL-23可能不是AS的理想治疗靶点 。
 文章插图
文章插图
图2:IL-12/IL-23p40抑制剂乌司奴单抗在axSpA中缺乏疗效
 文章插图
文章插图
图3:risankizumab没有达到主要研究终点——ASAS40应答率无显著提高
阻断IL-17A是治疗AS的有效方法
靶向IL-17A的治疗方案已得到肯定 。 它不仅驱动慢性炎症 , 也参与调控其骨代谢的全过程 , 与AS的影像学进展紧密相关 。
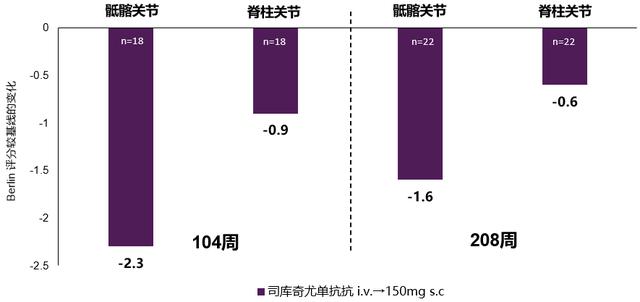
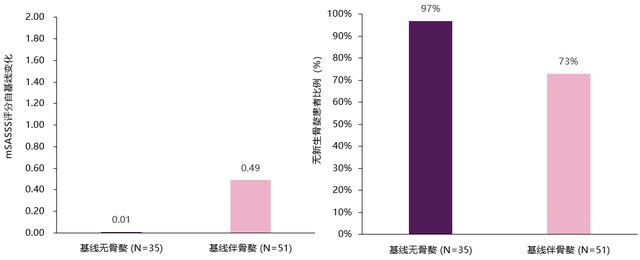
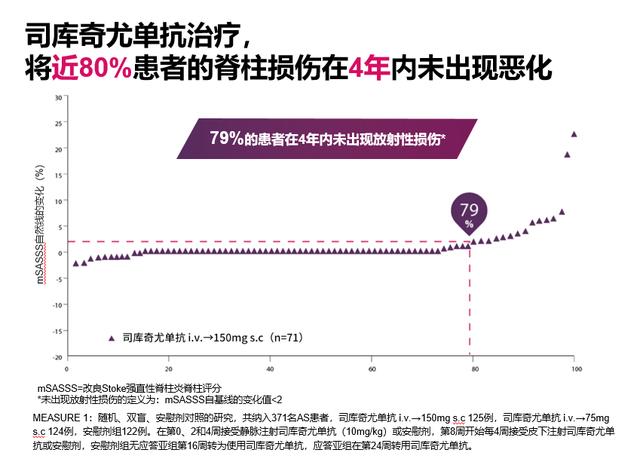
MEASURE 1研究数据显示 , 司库奇尤单抗在长期治疗过程中 , 可有效降低Berlin评分、延缓影像学进展(图4)[21];治疗2年 , 无论患者基线是否伴有韧带骨赘 , 司库奇尤单抗均可稳定其mSASSS评分进展、减少新生骨赘的形成(图5)[22];治疗4年内 , 近80%司库奇尤单抗治疗的AS患者未出现脊柱损伤的恶化(即mSASSS自基线的变化值<2 , 图6)[21] 。
 文章插图
文章插图
图4:MEASURE 1 研究显示 , 司库奇尤单抗长期治疗 , 可有效降低Berlin评分 , 延缓影像学进展
 文章插图
文章插图
图5:司库奇尤单抗治疗2年 , 无论患者是否伴韧带骨赘 , 均可稳定mSASSS评分进展 , 减少新骨赘形成
 文章插图
文章插图
图6:司库奇尤单抗治疗4年内 , 未出现影像学损伤(mSASSS自基线的变化值<2)
现有很多临床研究都使用mSASSS的平均变化作为评估药物对影像学进展作用的结局指标 。 但对于AS治疗的一线药物非甾体抗炎药物(NSAIDs)和主要的生物制剂肿瘤坏死因子抑制剂(TNFi)的影像学抑制作用 , 目前尚无定论[23] 。 2019年最新荟萃分析显示 , TNFi长期治疗下 , 虽能有效地抑制炎症和降低疾病活动度 , 但对AS患者影像学的表现并无显著改善作用(图7)[24] 。 因此 , 其结果仍需进一步确认 。
- 市六医院开展电子支气管镜检查造福呼吸系统疾病患者
- 糖尿病患者:外出饮食注意事项,一步都不能马虎
- 腰椎间盘突出症患者该怎样运动?
- 乙肝患者,身体发出4个信号,病情或在恶化,及时就医,不能拖
- 贵州省肿瘤医院妙手帮助安徽患者摘下6斤重肿瘤
- 患者|同济大学附属同济医院与蚌埠三院麻醉科联合举办“超声引导下新型连续神经阻滞麻醉及镇痛技术”培训班
- 2 855 例肺炎合并内科脓毒症患者预后影响因素研究
- 「专家说」微创保胆取石术后,患者需要注意这些事情
- 粤滇合作医疗团队一来,云南永善92岁患者在家门口被治愈
- 肛门病手术=受“酷刑”?医生说“不”!厦门市中医院开展止痛新技术 解患者后“股”之忧
