
文章图片

文章图片
文章图片
文章图片
文章图片

文章图片

文章图片
文章图片

文章图片
文章图片
文章图片
文章图片

文章图片
文章图片

文章图片
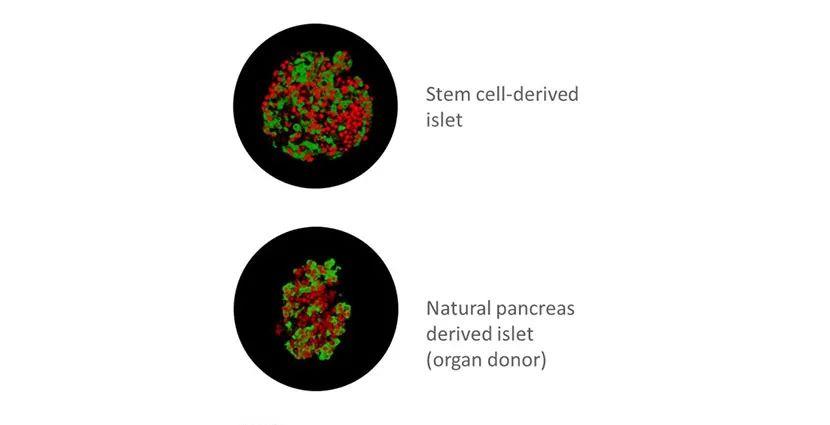
文章图片

文章图片

2021年9月12日 , 是胰岛素发现整整100周年 。 胰岛素的发现不仅扭转了诸多糖尿病患者“确诊即死亡”的命运 , 也加深了医学对自身免疫性疾病以及精准医疗领域深刻的理解 。 对糖尿病的认知起源于20世纪初 , 科学家从一只狗的试验“摘除了胰腺会导致高血糖”判断:糖尿病病人的尿糖与血糖增高和胰腺密不可分胰腺可通过胰岛β细胞分泌一种内源物质调节血糖 。 这种物质就是“胰岛素”是当时唯一被证实可在机体内降低血糖的物质 。 而且在发现初始 , 技术的不成熟使得胰岛素在除去胰腺的狗的体内并未达到所期望的降血糖效果 。 因而当时 , 糖尿病被称为“不治之症” 。
△ 1923年诺贝尔生理或医学奖获得者
直到1922年 , 加拿大外科医生Banting在多伦多大学Macleod教授支持下 , 首次成功分离纯化出有活性的胰岛素提取物 , 并使一个14岁糖尿病患者成功活到26岁 。 胰岛素发现两年后 , Banting和Macleod获得了诺贝尔生理学或医学奖 。 科学认识糖尿病的发病机制:分型的不同奠定治疗的差异化
胰岛素普及后 , 医学综合糖尿病病人的胰岛素水平和自身免疫的研究 , 将糖尿病划分为I型糖尿病(“T1DM” , 胰岛素依赖型)和II型糖尿病(“T2DM” , 胰岛素抵抗型) 。 普遍研究认为 , T1DM是慢性自身免疫性疾病 , 具有遗传倾向 , 由于个体遇到刺激因素激活针对胰岛的自身免疫反应 , 导致胰岛β细胞损伤和胰岛素缺失而出现高血糖 。 因此对T1DM , 产生可分泌胰岛素的胰岛β细胞为治疗的主要导向 。
△ T1DM发病机制:胰岛β细胞受损 , 导致胰岛素分泌绝对不足造成
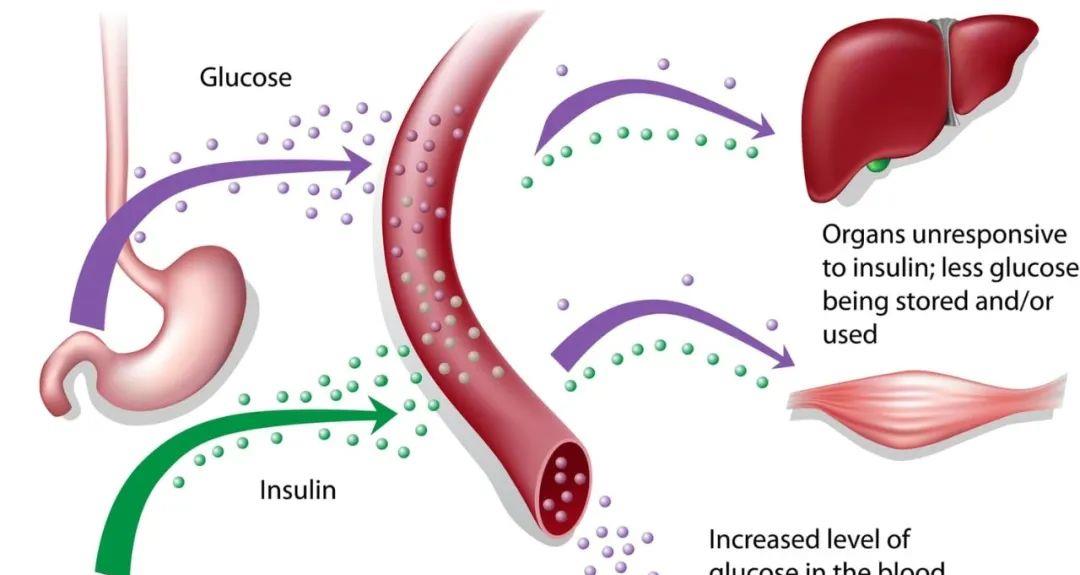
通过人群遗传分析 , 在全球4.6亿糖尿病患者中 , 中国约占1.3亿人 , 其中约5%-10%是T1DM 。 目前由于缺乏能稳定预测T1DM发病的生物标记物 , 外加复杂的遗传形式、疾病表型和环境因素 , 为T1DM遗传基因鉴定以及早期预防和干预带来了重大的挑战 。 而对于T2DM而言 , 胰岛素敏感程度和β细胞的胰岛素分泌能力对疾病的发生起到至关重要的作用 。 研究发现 , 在T2DM确诊十年前病人就可能出现胰岛素敏感度降低 , 但胰岛β细胞会提高胰岛素表达以控制血糖 。 但长期的胰岛素过量表达会加重胰岛β细胞的负担 , 包括氧化应激和内质网压力在内多种机制会导致胰岛β细胞损伤 , 胰岛素分泌量会逐渐减少 , 最终导致血糖失控 。
- 大白鲨|10条关于大白鲨的冷知识,幼鲨在母亲子宫里就开始互相残杀
- 空间站|东方红一号仍在飞行,天宫空间站已值班,能用机械臂带它回家吗?
- 外星人|外星人一定是“人”吗?他们的存在形式或超乎想象!
- 太空望远镜|即将发射的韦伯太空望远镜有多牛?可以在月球上探测到地球上一只黄蜂的热量特征
- 联想|在电脑城几年的工作经历,谈谈对联想电脑的几点认识
- ipad mini|想入手iPad mini 5,又觉得没什么用,iPad实用性在哪里?
- 亚马逊|2019年,一头座头鲸出现在亚马逊雨林中,生物学家百思不得其解!
- 化石|传说中的“龙”或真实存在1:大量证据表明,人类早已发现其踪迹
- 红米手机|5000mAh+90Hz高刷+128G储存,现在仅售1199元,性价比太高
- 交易|走不出“围城”的国内互联网企业,与美企差距在哪儿?
