部分脑损伤无需CT初筛,首个血液检测TBI测试获FDA批准,美国国防
傻大方提示您本文标题是:《部分脑损伤无需CT初筛,首个血液检测TBI测试获FDA批准,美国国防部支持》。来源是雷锋网。
部分脑损伤无需CT初筛,首个血液检测TBI测试获FDA批准,美国国防部支持。美国|fda|国防部|血液|损伤---
美国|fda|国防部|血液|损伤---傻大方小编总结的关键词
雷锋网按:近日,美国食品药品监督管理局(FDA)正式批准了Banyan Biomarkers公司“通过血液检测成人TBI(创伤性脑损伤)”的项目测试。
Banyan Biomarkers是一家多年从事研究TBI体外诊断产品的公司,公司专注开发一种能在诊疗现场实施简便易行的验血方法,用于检测脑创伤是否存在及其严重程度,从而改善头部损伤患者的医疗救护。
2010年这家公司曾获得美国国防部2630万美元的合约,与国防部合作开发用于TBI的验血方法,助力医护人员对军队伤员进行分类。
据悉,全球每年受外伤性脑损伤困扰的患者约有1000万人,其中美国每年大致有200万人因TBI在急诊接受治疗。交通事故、跌倒、运动致伤均为TBI最常见的病因。
据估计,在伊拉克和阿富汗战场上,多达20%的退伍军人因炸弹爆炸而罹患不同程度的外伤性脑损伤。
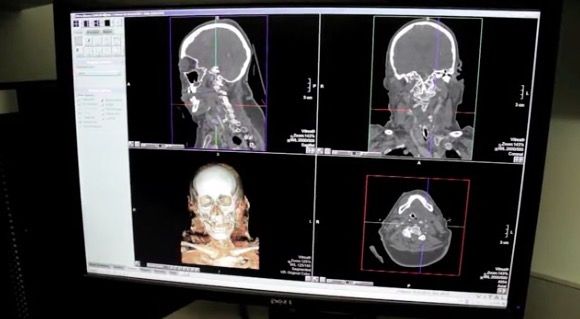
由于缺乏批准的生物标志物来指导决策,医生第一步默认选择CT扫描评估患者脑损伤,用以检测出血或其他异常,辅助对TBI的评估。
但用CT扫描存在三大问题:
对部分损伤检测效果并不理想
CT检查本身对人体有害
成本较高
在扫描效果上,采用医学影像检查诸多轻度脑损伤(包括脑震荡),多数情况往往并未显示异常,约有超过90%的患者CT扫描呈阴性。
在价格层面,美国TBI的CT检查成本在800到1500美元之间,而相关血液检测的成本在不久的将来约为150美元。
雷锋网了解到,近期FDA批准的Banyan Biomarkers临床研究测试,从有脑震荡或轻微创伤性脑损伤的人群中提取了1900个血液样本,评估UCH-L1(泛素羧基末端水解酶L1)和GFAP(胶质纤维酸性蛋白)的水平。科学研究表明,UCH-L1和GFAP在大脑受损时被释放,并通过血脑屏障进入血流。
美国|fda|国防部|血液|损伤---傻大方小编总结的关键词
Banyan Biomarkers在患者受伤的15或20分钟内可以在血液中检测到高水平的蛋白质,测试可在受伤后12小时内进行,3到4小时内得到初筛结果,减少不必要的CT辐射暴露。阳性患者需进行下一步的CT扫描来确认,看否进行手术或其他治疗。
与CT扫描相比,血液测试在检测脑震荡时的有效性为97.5%,在排除脑震荡时的有效率为99.6%。
据悉,这项测试将首次在急诊室中使用,最早将于年底投入使用。其中Banyan Biomarkers已经与法国公司bioMerieux SA合作,通过使用bioMerieux的血液分析仪在医院进行测试。
Banyan Biomarkers CEO 诺德霍夫指出,他希望在不久的将来,他们的技术和产品不仅可以在医院中使用,同时可以以更为便捷易用的手持设备产品形态,被直接用于战场和球场伤员的检测当中。
美国食品药品监督管理局局长Gottlieb博士说在一份声明中指出,这项检测“为更现代化的疑似病例检测护理标准奠定了基础”。不少医学专家也纷纷表示,这无疑是一项重大进步。
目前全球其他公司也在积极开发类似的血液检测脑损伤产品。
医疗保健巨头雅培已经从Banyan Biomarkers获得了这两种蛋白质生物标志物,并正在记性自己的血液测试。BioDirection也在开发一项测试,该测试涉及到Banyan Biomarkers试验里的一种蛋白质,通过便携式设备,在不到两分钟内产生结果检测结果。雷锋网
- 九种人,擦肩即可,无需深交;拿你当傻子的人,一辈子都别交
- 大年初一降雪,省内部分高速封闭!最新:全省多地发布道路结冰预警
- 泰安:除夕至初二 跨省市部分线路停运
- 大年初一降雪,哈同高速多车相撞!部分高速公路封闭(视频)
- 北方人冬天爱吃的一种早餐,大部分南方人接受不了
- 人工智能可以3D建模了?3D打印未来无需自己建模
- 墨西哥强震致瓦哈卡州部分建筑受损 暂无死亡报告
- 湖北:因大雾部分高速段临时禁行
- iOS 11 系统越做越烂,原因是...
- 汽车圈这几大谣言 大部分新手司机都被骗过
