按关键词阅读:

文章图片
2020年10月巴西圣保罗大学Luiz G. Gardinassi和Lúcia H. Faccioli两位学者于Nature communications发表文章Interleukin-1 receptor-induced PGE2 production controls acetylcholine-mediated cardiac dysfunction and mortality during scorpion envenomation , 其研究发现意外中蝎子毒后 , 建议在放毒后尽早使用地塞米松 , 甚至在抗血清之前使用 , 以抑制炎症介质的产生和乙酰胆碱的释放 , 并降低死亡风险 。
严重的蝎子毒化会导致肺水肿和心脏功能障碍 , 并可能发展为致命的后果 , 尤其是在儿童和老年人中 。 提提俄斯serrulatus蝎毒(TSV)是通过模式识别受体(PRR) , 其诱导产生的细胞因子和脂质介体 , 如类二十烷酸的识别 。 TsV被巨噬细胞识别会导致NLRP3炎性小体激活和白介素1β(IL-1β)释放 , 从而促进肺水肿和死亡率 。 抑制前列腺素E 2(PGE 2)产生或施用白三烯B 4(LTB 4)抑制IL-1β释放 , 消除TsV诱导的肺水肿和死亡率 。 不幸的是 , 新疗法的发展受到局限 , 主要是由于缺乏有关临床表现病因的机制的信息 。 这包括心脏功能障碍 , 这被认为是与蝎毒引起的高死亡率相关的主要病理生理事件之一 。
目前 , 已知的是 , 存在于TSV激活离子通道的毒素诱导已知为神经递质风暴一个神经兴奋综合征 , 与自主神经系统的过度活化相关联的过度响应 , 从而导致TSV诱导的心源性休克和其他全身表现形式 。 自主神经系统分成通过乙酰胆碱的释放(ACH)和儿茶酚胺执行在维持体内平衡的相反功能副交感神经和交感神经系统 。 ACh的过度释放导致心动过缓 , 心律不齐 , 鼻腔 , 唾液 , 泪腺 , 胰腺和支气管分泌物增多 , 并有毛发竖立和肌肉痉挛 , 而夸大的儿茶酚胺产生会介导心律不齐 , 心动过速 , 高血压 , 休克 , 高血糖 , 和白细胞增多 。 根据这些表现的强度 , 浸毒的哺乳动物可以发展为严重的动脉低血压 , 并随后死亡 。 尽管在严重蝎子毒化期间已认识到这些神经递质对心源性休克和死亡的贡献 , 但其传递的分子机制仍不清楚 。
在跨学科研究的最新进展已经描述了(i)所述的免疫系统的相关性在的心血管功能的调节心血管系统和(ii)的神经信号的生理控制 , 以及在心脏的免疫应答 。 考虑到这些研究 , 研究人员假设TsV引起的心脏功能障碍和随后的死亡是通过特定的脑-心脏神经回路的神经免疫相互作用而发生的 。 通过结合遗传 , 外科和药理学方法 , 研究人员着手通过探索将自主神经与心脏固有免疫反应联系起来的神经和分子事件的层次 , 以机械方式研究神经递质风暴 。
文章图片
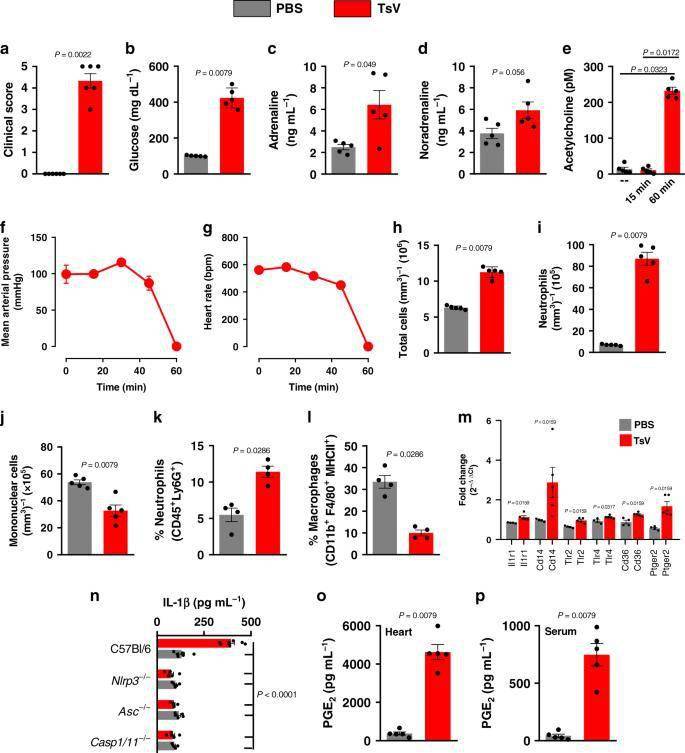
图1:TsV诱导全身性表现和心脏炎症
研究人员数据显示蝎子的毒化会诱导小鼠自主神经过度活跃和心脏炎症 。 心脏成纤维细胞在体外对TsV产生反应并产生PGE 2和IL-1β 。 此外 , IL-1R信号传导对于持续的PGE 2产生 , IL-1β释放的放大 , 心脏功能障碍和体内死亡率是必需的 。 确实 , PGE 2通过EP2 / 4受体的信号转导介导的ACh释放过多 , 进而导致被毒鼠的心力衰竭 。 重要的是 , 研究人员引入了地塞米松而不是抗蝎毒液血清靶向的新型途径 。 综上所述 , 研究人员的研究表明抑制炎症反应可以是预防蝎毒引起的心脏功能障碍和死亡的有效支持疗法 。
自主系统和过度的炎症的蝎蛇毒素时的超活化先前已记录; 然而 , 从未研究过通过操纵自主神经系统引起毒液引起的心血管功能障碍和死亡率的机制 , 特别是从神经免疫学的角度 。 在本研究中 , 研究人员首次建立了炎症过程 , 神经元激活 , 心脏功能障碍和蝎毒引起的死亡率之间的直接关系 。 同样 , 研究人员证明了 , 尽管蝎毒给药后副交感神经/迷走神经和交感神经系统都被过度激活 , 但只有先阻滞才能阻止通常在有毒小鼠中观察到的心血管改变和死亡率 。 
稿源:(健康界)
【】网址:http://www.shadafang.com/c/hn1104c4NH020.html
标题:心脏|Nature communications:地塞米松治疗蝎子毒具有奇效
