
文章图片

文章图片
文章图片
【神经元|多组学研究揭示中间神经元分化过程的奥秘】把本文由brainnews脑科学世界团队原创编译 , 转载请联系授权 。
大脑皮层的一大特点在于其中间神经元的多样性 。 小清蛋白阳性(PV+)和生长抑素阳性(SST+)细胞作为最大的两类皮层中间神经元 , 起源于内侧神经节隆起(MGE)的共同细胞谱系 , 而在成年期表现迥异的形态和功能 。 因此 , 研究这两类细胞如何获得各自的细胞“身份”是一个良好的切入点 。
哈佛医学院的Gord Fishell团队和纽约大学的Richard Bonneau团队于2021年9月22日在Nature发表原著论文 , 联合应用单细胞ATAC测序和单细胞RNA测序 , 揭示了染色质结构和转录组的变化如何表征小鼠大脑皮层PV+和SST+中间神经元的分化 。
研究人员首先探究了在MGE中中间神经元和投射神经元何时开始分化 。
研究人员通过对Dlx6acre;Ai14小鼠的E13的MGE中正在进行有丝分裂的祖细胞和已完成有丝分裂的前体细胞进行单细胞ATAC测序、单细胞RNA测序和多组学(dual RNA and ATAC)测序 , 发现了可以表征分支1(中间神经元前体细胞)出现的染色质结构特征:相比于发育相关基因的基因表达的上调 , 其启动子可及性的上调出现更早且持续更久 。 与分支1相关的基因(例如Maf)的染色质远端元件的开放早于基因本身表达的上调 。
该结果提示了远端元件的染色质结构的开放可能表征了中间神经元分化的开端 。
图1. 染色质远端元件提供了中间神经元出现的最早标志
研究人员想要探究的第二个问题是中间神经元何时开始向不同类型分化 。
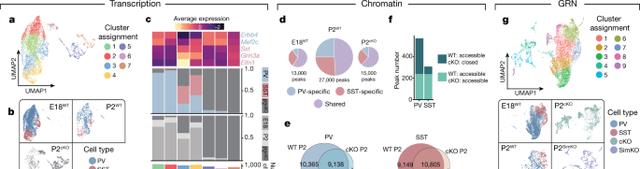
通过对Dlx6acre;INTACT小鼠的E18、P2、P10、P28的皮层中间神经元进行单细胞RNA测序和单细胞ATAC测序 , 研究人员发现降维后得到的RNA和ATAC数据的clusters在P10和P28时间点高度一致 , 而在E18和P2时间点表现出高度差异性 。
通过分析PV特异性和SST特异性的ATAC峰 , 研究人员发现这些特异性的峰最早出现在P2时间点 。 因此 , 中间神经元在P2(中间神经元完成向皮层的迁移)时间点开始出现细胞类型特异性的染色质结构重塑 。
通过分析在不同时间节点的转录因子基序的富集情况 , 研究人员发现大多数转录因子基序被PV和SST中间神经元共享 , 仅有少部分为细胞类型特异性 , 例如MEF2C从P2时间点开始特异性地为PV神经元所利用 。
但是值得注意的是 , 研究人员对P28时间点的PV和SST神经元进行了针对MEF2C的CUTRUN测序 , 发现MEF2C结合的染色质位点有一部分为SST神经元共享的或SST特异性位点结合的 。 该结果说明MEF2C虽为PV特异性的转录因子 , 但也参与SST神经元的基因调控 。
图2. 中间神经元在皮层定居后发生染色质结构重塑
以上结果表明 , 在中间神经元的发育过程中 , 基因表达和染色质结构随着神经元向皮层的迁移 , 逐渐从不一致转向一致 。 为了表征这一动态变化过程 , 研究人员针对E18、P2和P28的时间点构建了基因调控网络 。
结果显示细胞特异性的基因-转录因子互作逐渐取代共享的互作 。 并且 , 共享的转录因子也从调控共享的互作逐渐转为细胞特异性的互作 。 这些结果表明染色质结构的改变在不需要选择性表达转录因子的情况下 , 介导了细胞类型特异性的基因调控 。
图3. 细胞类型特异性的调控互作的出现表征了基因调控网络的成熟
进一步 , 研究人员选择性敲除PV和SST神经元中的Mef2c , 发现Mef2c的缺失显著影响PV神经元的成熟 , 但通过聚类分析发现选择性敲除小鼠的SST神经元的cluster与野生型小鼠的SST神经元的cluster相互分离 , 说明Mef2c的缺失也影响了SST神经元的成熟 。
通过单细胞ATAC测序 , 研究人员还发现基因敲除小鼠在P2时间点的细胞的峰的特征类似于野生型小鼠在E18时间点的特征 , 说明Mef2c的缺失使细胞成熟严重滞后 。
该结果表明Mef2c同时参与了PV和SST神经元在生后早期发育中的染色质结构重塑 , 尤其在PV神经元中发挥重要作用 。 最后 , 研究人员根据基因调控网络模拟Mef2c敲除 , 发现模拟结果能高度预测真实敲除结果 。
图4. Mef2c的缺失不成比例地影响PV神经元的基因调控网络
- 科学家|科学家预言:“未来人类将培育出所有人体器官。”
- 科学家|中国跨越式发展!“人造粮食”研发大获成功,有望解决粮食危机?
- 医生|全国400余位专家呼吁:脐带血很多优势,科学认识它!
- 亚马逊|2019年,一头座头鲸出现在亚马逊雨林中,生物学家百思不得其解!
- 科学家|宇宙中五个让人不能深思的问题,越想越觉得不可思议
- 微生物|吸氧90天,年轻25岁?以色列科学家:不是一般的氧气
- 科学家|南非科学家发现新病毒变种
- |人工智能揭示了以前未知的生物学--我们可能不知道我们细胞中的一半内容
- 亚马逊|机器学习解决了谁是谁的问题
- 卫星|大学生搞出“饿了么”,668亿卖给马云, 转身投资教育产品再赚百亿
