crispr|诺贝尔化学奖授予CRISPR研究!两位女性科学家获奖

本文图片
刚刚 , 2020年诺贝尔化学奖揭晓 。 法国生物化学家埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)、美国生物学家詹妮弗·杜德纳(Jennifer Doudna)因对新一代基因编辑技术CRISPR的贡献 , 摘得今年的奖项 。
本文图片
左图为卡彭蒂耶 , 右图为杜德纳
埃马纽埃尔·卡彭蒂耶生于1968年 , 现任马克思·普朗克生物感染研究所主任 , 同时是瑞典于默奥大学的访问教授 。 詹妮弗·杜德纳生于1964年 , 现任加州大学伯克利分校化学及化学工程系教授 。
2011年 , 杜德纳开始与卡彭蒂耶合作发展CRISPR技术 。 一年后 , 两位女生物学家在《科学》杂志发表论文并首次指出 , CRISPR-Cas9系统在体外实验中能“定点”对DNA进行切割 , 显著提升了基因编辑的效率 , 为该领域的发展奠定了基础 。 两位科学家被《时代》周刊评为2015年全球最具影响力100人 , 并收获了包括生命科学突破奖在内的多项生命科学大奖 。
CRISPR-Cas9 基因编辑系统是本世纪最为重要的生物发现之一 。 2015年 , 《科学》将它评为年度突破;助力这项技术诞生的科学家们也先后获得了有“科学界奥斯卡”之称的“突破奖”(Breakthrough Prize) , 在分子生物学界影响深远的“格鲁伯遗传学奖”(Gruber Genetics Prize) , 以及表彰重大生物医学突破的“沃伦·阿尔珀特奖”(Warren Alpert Prize) 。
在2014年12月的《环球科学》中 , 《编辑基因:更快、更准、更简单》一文就对这项技术的作用机制、发展历程及前景展开详细介绍 。 虽然争议尚存 , 但毫无疑问 , 这项在2015年被《科学》杂志评为“年度科学突破”的新兴技术 , 正在开创一个全新的时代 。
撰文?玛格丽特·诺克斯(Margaret Knox)
翻译?马文静
1973年 , 斯坦利·N·科恩(Stanley N. Cohen)和赫伯特·W·博耶(Herbert W. Boyer)找到了改变生物体基因组的方法 , 成功将蛙的DNA插入到细菌中 。 20世纪70年代末 , 博耶的基因泰克(Genetech)公司对大肠杆菌进行基因改造 , 使其带有一个人源基因(这个基因是人工合成的) , 最后生产出治疗糖尿病的胰岛素 。 很快 , 加利福尼亚州拉霍亚的索尔克生物研究所(Salk Institute for Biological Studies)的科学家培育出了第一只转基因小鼠 。
基因工程领域取得的这些巨大成就改变了现代医学的进程 。 但是 , 早期的基因改造方法有两大局限:不甚精确 , 并且难以量产 。 那时 , DNA插入基因组的行为是随机的 , 科学家只能祈求好运 , 但愿自己能得到一个有用的突变 。 1990年 , 研究人员取得了跨越式的进步 。 他们设计出能在特定位点对DNA进行剪切的蛋白 , 突破了第一个局限 。 但是 , 每想要修改一段DNA序列 , 他们都必须设计一个新的蛋白 , 这种工作非常耗时 , 并且十分艰苦 。
时间终于到了2012年 。 瑞典于默奥大学(Ume? University)的埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)和加利福尼亚大学伯克利分校的珍妮弗·杜德娜(Jennifer Doudna)领导的研究人员报道 , 他们在细胞中发现了一种遗传机制 , 能让科学家以前所未有的速度编辑基因组 , 并且过程十分简单 。 此后不久 , 哈佛大学和麻省理工大学的一个课题组运用这种技术 , 一次性地对细胞基因组的多个位点进行了修改 。
这种先进的技术已经加快了基因工程产业的发展 , 对遗传学和医学也有深远的推动作用 。 科学家现在只要几周时间 , 就能按需定制出经过基因改造的实验动物 , 省去了从前一年的工作量与时间 。 目前 , 研究人员正在运用该技术 , 探索艾滋病、阿尔茨海默病、精神分裂症等疾病的治疗方法 。 该技术将生物体的基因修饰过程变得相当简单与廉价 , 研究人员和伦理学家甚至开始担心 , 这会催生负面效应 。
这种技术名叫CRISPR , 是“clustered, regularly interspaced, short palindromic repeats”(即成簇、规律间隔的短回文重复序列)的缩写 。 利用这种序列 , 细菌可以对侵袭过它的病毒产生“记忆” 。 自从日本科学家20世纪80年代末发现CRISPR之后 , 科学家就一直在研究这种奇怪的基因序列 。 然而 , 直到杜德娜和卡彭蒂耶偶然注意到一种名叫Cas9的蛋白 , CRISPR才显示出它作为基因组编辑工具的巨大潜力 。
RNA的力量
2011年 , 杜德娜和卡彭蒂耶在波多黎各圣胡安的一次科学会议上相识 。 他们有很多共同点:他们的团队都在研究细菌防御病毒入侵的机制;他们都已经确认 , 细菌可以记住以前入侵过自己的病毒的DNA , 以此来识别病毒 , 当该病毒再次入侵时 , 它们就会立刻认出“敌人” 。
那次会议后不久 , 卡彭蒂耶和杜德娜决定合作 。 当时 , 卡彭蒂耶在于默奥大学的实验室刚刚发现 , 链球菌似乎会用Cas9蛋白来“捣碎”突破其细胞壁的病毒 。 于是 , 杜德娜在伯克利的实验室 , 也开始探究Cas9蛋白的作用机理 。分页标题
很多科学发现的背后都有一连串巧事 , CRISPR的故事也不例外 。 卡彭蒂耶实验室的克日什托夫·黑林斯基(Krzysztof Chylinski)和杜德娜实验室的马丁·伊内克(Martin Jinek)在毗邻的城镇长大 , 说着同样的波兰方言 。 杜德娜说:“他们开始通过Skype聊天 。 两人一拍即合 , 然后就开始分享数据、讨论做实验的想法 。 这个项目就这样正式开始了 。 ”
两个实验室的科学家都意识到 , 他们或许可以用Cas9蛋白来进行基因组编辑 。 基因组编辑是基因工程中的一种方法 , 酶是这一过程中的“分子剪刀” , 可以剪切DNA 。 这种酶名叫核酸酶(nuclease) , 能在特定的位点切断双链DNA 。 DNA断裂后 , 细胞会对断裂位点进行修复 。 有时 , 细胞中一些人为导入的基因片段 , 会在修复的过程中插入这些位点 。 杜德娜和卡彭蒂耶刚开始合作的时候 , 科学家如果想改变或关闭一个基因 , 最先进的方法 , 是定制一种能找到特定DNA位点并对其进行切割的酶 。 换句话说 , 每修饰一次基因 , 科学家都不得不设计一种新的蛋白 , 专门针对想要修饰的DNA序列 。
但杜德娜和卡彭蒂耶意识到 , Cas9蛋白——这种链球菌用于免疫防卫的酶 , 会用RNA来引导自己找到目标DNA 。 为了探测作用位点 , Cas9-RNA复合物会在DNA上不停“弹跳” , 直到找到正确的位点 。 这一过程看似随机 , 其实不然 。 Cas9蛋白的每次弹跳 , 都是在搜索同一段短小的“信号”序列 。 Cas9会附着到DNA上 , 检测邻近的序列是否和充当向导的RNA匹配 。 这种RNA叫做向导RNA(guide RNA , 简称gRNA) , 而只有当gRNA和DNA匹配时 , Cas9蛋白才会对DNA进行切割 。 如果能将这套天然的RNA向导系统利用起来 , 研究人员在切割DNA位点时 , 就不用每次都构建一种新的酶了 。 基因组编辑可能会因此变得更简单、更便宜 , 也更有效 。
这个横跨大西洋的团队一起对Cas9蛋白进行了几个月的研究 , 并且取得了突破 。 杜德娜还能清楚地记起那个时刻 。 他们的实验室坐落在伯克利校园边缘一个绿树成荫的山坡上 , 对面就是希腊剧院 , 彼时还在做博士后研究的伊内克一直那里在对Cas9蛋白进行实验 。 一天 , 他来杜德娜的办公室讨论实验结果 。 面对伊内克和黑林斯基一直在讨论的一个问题 , 他们陷入了沉思:在自然界中——也就是在链球菌体内 , Cas9蛋白倚靠的不是一个 , 而是两个RNA , 来引导自己寻找DNA上的正确位点 。
如果在保留其向导功能的前提下 , 将两条gRNA整合成一条RNA链 , 结果会怎么样呢?如果只需修饰一个RNA序列 , 研究人员的工作速度将会得到极大的提升 。 gRNA序列与目标DNA序列之间存在精妙的互补关系 , 利用这种关系构建一条gRNA , 比定制一个核酸酶更容易 。
“看着这些数据 , 我们突然就开窍了——这种事情经常发生 , ”杜德娜说道 , “我们意识到 , 其实可以将这些RNA分子设计成一条gRNA 。 一套由一个蛋白质和一条gRNA组成的系统 , 就足以成为一个强大的基因修饰工具 。 我打了个寒颤 , 心想 , ‘天哪 , 我要赶快跑到实验室去 , 如果这能成功的话……’”
他们真的成功了 。 结果超出了杜德娜的设想(尽管她本来就抱有很高的期待) 。 2012年8月17日 , 当杜德娜和卡彭蒂耶将他们对CRISPR-Cas9的研究成果公诸于众时 , 该领域的科学家立刻认识到这一技术的变革性力量 , 他们都想知道CRISPR-Cas9究竟能做什么 , 一场全球性竞赛由此拉开序幕 。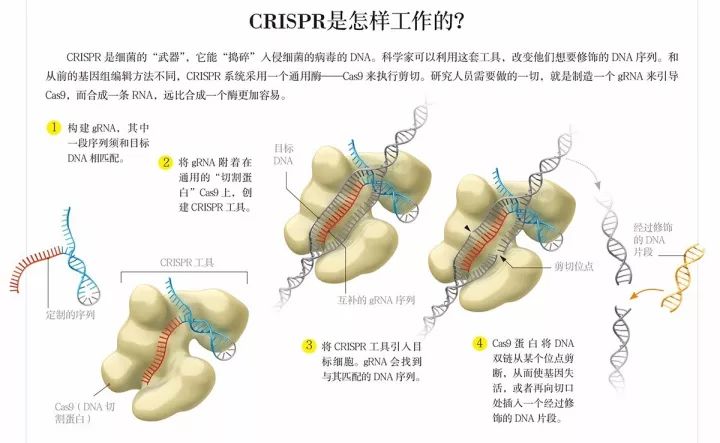
本文图片
快速商业化
2013年之前 , 研究人员一直在尝试将CRISPR-Cas9应用于植物和动物细胞——它们比细菌要复杂得多 。 在他们看来 , 这和复活尼安德特人与猛犸象一样激动人心 。 在哈佛大学 , 遗传学家乔治·丘奇(George Church)领导的团队用CRISPR技术来改变人类基因 , 为疾病的治疗提供了多种可能性 。
CRISPR-Cas9很快成为了投资的热点 。 2013年 , 杜德娜联手丘奇、麻省理工学院的张峰和其他研究人员 , 共同成立了爱迪塔斯医药公司(Editas Medicine) , 他们获得了4 300万美元的风险投资 , 用以开发一类新的、基于CRISPR的药物 。 2014年4月 , 获得2 500万美元投资的CRISPR医疗公司(CRISPR Therapeutics)在瑞士巴塞尔和英国伦敦成立 , 他们的目标也是开发基于CRISPR的疾病疗法 。 爱迪塔斯医药公司和CRISPR医疗公司都需要多年时间 , 才能开发出相应的疗法 , 然而 , 实验室的供货商们已经在向世界各地的客户销售可以立即用于动物注射的CRISPR材料 , 并开始为客户定制经CRISPR改造的小鼠、大鼠和兔子 。
2014年 , 我在一个潮湿的夏日拜访了位于圣路易斯的SAGE实验室(SAGE Labs) , 它是第一批获准使用杜德娜的CRISPR技术来改造啮齿类动物的公司之一 。 在那里 , 我能亲眼见识CRISPR是如何起作用的 。 SAGE实验室向大约20家顶级制药公司 , 以及众多高校、研究所和基金会供应实验材料 。 英国剑桥的生物技术公司地平线发现集团(Horizon Discovery Group)早前也已独立涉足CRISPR产品的研发;2014年9月 , 他们又以4 800万美元收购了SAGE实验室 。 SAGE实验室位于一个工业园区内 , 建在一条马路尽头的一组低矮的办公建筑里 。 这里的科学家收到一个来自实验室的网上订单:加利福尼亚州萨克拉门托(Sacramento)的一个实验室为研究帕金森病 , 订购20只敲除了Pink1基因的小鼠 。 建筑新修的侧楼耗资200万美金 , 里面是为客户定制的基因改造大鼠 , 以及其他经CRISPR改造的啮齿类动物 。 这些动物生活在超净、恒温的笼子里 , 笼子整整齐齐地放在一起 , 从地板一直排到天花板 。 工作人员填写订单、选出相应的20只大鼠 , 将它们轻轻地放在盒子里打包 , 然后空运到加利福尼亚——整个流程就是这么简单 。 如果有人想要研究精神分裂症或疼痛控制 , 也可以这样订购实验动物 。分页标题
不过 , 如果仓库里没有客户想要定制的那种动物 , 流程就不一样了 。 例如 , 有一个客户想要研究帕金森病和一种新发现的可疑基因(或者一个基因的特定突变)之间的关系 , 当他到SAGE实验室订购啮齿类动物的时候 , 有几个选择 。 SAGE实验室的科学家能用CRISPR技术“关掉”目标基因 , 制造一个突变;他们也可以关掉目标基因 , 然后再往里插入一个人源基因 。 从帕金森病到囊性纤维化 , 再到艾滋病 , 许多疾病都和基因突变有关 。 过去 , 科学家需要一年时间 , 才能培育出这些带有复杂基因突变的实验动物 。 但CRISPR不同于以往的基因组编辑技术 。 利用这种技术 , 研究人员能同时在细胞内快速地改变多个基因 。 培育基因工程动物的时间已因此缩短到几周 。
SAGE的员工首先使用化学试剂盒 , 合成客户定制的DNA , 以及与这条DNA相匹配的RNA 。 他们将RNA和Cas9蛋白在培养皿里混合 , 一套具有基因组编辑功能的CRISPR工具就诞生了 。 然后他们会花上大约一周的时间 , 用一种外形类似于扫描仪的仪器 , 测试该工具在动物细胞内的功能 。 这种仪器能够发射电流 , 将CRISPR工具注入细胞 。 进入细胞的CRISPR工具会立刻开始工作 , 对DNA进行剪切 , 进行小量的基因插入与删除 。 CRISPR并非100%有效:在某些细胞里 , 它们会剪切DNA、制造突变 , 在另一些细胞里则完全不起作用 。 为了观察CRISPR的表现究竟如何 , 科学家会从细胞中收集DNA , 将它们集中起来 , 并将目标位点附近的dna片段复制多个拷贝 。 他们会对这些DNA进行处理与分析 , 然后查看显示在电脑屏幕上的分析结果 。 如果CRISPR成功切开目标位点 , 制造出突变 , 屏幕上就会显示出一条模糊的条带 , 并且 , CRISPR剪切过的DNA越多 , 条带就越明亮 。
接下来 , “战场”转移到了侧楼的动物实验室里 。 科学家就是在这里制造出经基因改造的胚胎 , 以及突变过的啮齿动物 。 生物学家安德鲁·布朗(Andrew Brown)戴着外科手套、身穿蓝色的长袍、戴着套鞋和蓬松的帽子 , 弯腰伏在解剖显微镜前 。 他用玻璃移液管的尖端吸起一个大鼠胚胎 , 然后走到房间的另一头 , 将胚胎转移至另一台装有机械手臂的显微镜上 。 他将胚胎放到载玻片上的一滴液体里 , 固定到台面上 。 现在 , CRISPR就要发挥它的魔力了:他用右手控制操纵杆 , 一只机械手臂将一根空的玻璃针头扎入胚胎 。
从显微镜的目镜看去 , 胚胎中来自双亲的两个原核(pronucleus)就像是月球表面的环形山 。 布朗轻轻推动细胞 , 直到其中一个原核移到针尖的旁边 。 他点击电脑鼠标 , 一滴含有CRISPR的液体从针头喷出 , 穿过细胞膜进入细胞 。 原核立即像一朵快速盛开的花一样膨胀开来 。 布朗运气不错 , 一个突变细胞就此诞生了 。 SAGE实验室中有3个技术员 , 他们一周4天、一天300次地重复着这项工作 。
布朗将完成注射的大鼠胚胎吸入移液管 , 移进培养皿 , 存储在加热至动物体温的培养箱中 。 最后 , 他需要将30~40枚经过修饰的胚胎注射到代孕母鼠体内 。 20天后 , 代孕大鼠将怀上5~20个“孩子” , 当这些“孩子”长到10天大的时候 , SAGE实验室的科学家将抽取组织样本 , 检测哪个“孩子”带有改造过的基因 。
“这是最令人激动的时候 , ”布朗说道 。 20个胚胎中 , 可能只有1个能被成功改造 , 而改造成功的动物 , 就是我们所说的种源动物 (founder animal) 。 到了这一步 , 每个人都会庆祝一下 。 在我们看来 , SAGE实验室的科学家制造RNA、注射胚胎的方法似乎很简单 , 很多实验室也在用同样的步骤培养基因工程动物 。 正如SAGE的首席执行官戴维·斯莫勒(David Smoller)说的那样 , 这是可以“量产”的基因组编辑技术 。
前景与风险
CRISPR已经勇猛地踏上了商业化的征途 , 研究人员和商人都在为这种技术设想新的商业用途 , 其中的某些想法甚至有些狂妄 。 运用这种技术 , 医生或许可以在怀孕早期的妇女体内 , 改造与唐氏综合征有关的异常染色体;育种人员可以重新向抗性杂草的基因组中引入对除草剂敏感的基因;我们还可以复活已经灭绝的物种 。 这当然会让有些人感到害怕 。 比如 , 最近就有一些警告性的头条报道 , 将这种技术形容为“扮演上帝的好方法” , 或者“瓶中妖” 。 这些文章担心 , 当我们急于摆脱疟蚊 , 太想治好亨廷顿病 , 或者期望“设计”出更好的婴儿时 , 我们也可能是在创造一个充满有害新基因的“侏罗纪公园” 。
以哈佛大学研究人员提出的“灭蚊项目”为例 。 美国伍德罗·威尔逊国际学者中心(Woodrow Wilson International Center for Scholars)的生物安全分析师托德·库伊肯(Todd Kuiken)认为 , 战胜疟原虫是一回事 , 但要消灭这种寄生虫的载体 , 却是完全不同的另一项任务 。 如果我们的目标是根除疟疾这种每年感染两亿人、杀死60万人的疾病 , 我们就不得不小心 , 自己是否会制造出10个新麻烦 。 “我们必须想清楚 , ‘我们真要这样做吗?’如果答案是‘是’ , 我们有哪些可用的系统?有什么样的保障措施?”
科学家正在快速行动 , 他们希望预见CRISPR技术最可能的危害 , 并制定应对措施 。 2014年7月17日 , 当哈佛大学的团队发表一篇讨论如何用CRISPR消灭疟蚊的论文时 , 他们也在呼吁公众对这一问题进行讨论 , 他们也指出了基因改造在技术与监管上的窘境 。 该团队的生物伦理学家让蒂宁· 伦斯霍夫(Jeantine Lunshof)说:“CRISPR的发展如此迅猛 , 很多人还没听说过这种技术 , 但是我们确实正在使用它 。 这是一种新现象 。 ”现在 , 在伯克利的创新基因组计划 (Innovative Genomics Initiative) 的框架下 , 杜德娜正在组建一个团队 , 专门讨论应用CRISPR的伦理问题 。分页标题
如果对伦理问题的担忧 , 扑灭了人们对CRISPR的热情 , 后果将是不可想象的 。 例如 , 2014年6月 , 麻省理工学院的研究人员报道 , 他们直接从尾部向动物体内注射CRISPR , 治愈了患酪氨酸血症(tyrosinemia , 一种的罕见肝脏疾病)的成年小鼠 。 这种疾病由一种突变的酶引起 。 研究人员向小鼠体内注射了3种gRNA序列和Cas9蛋白 , 以及突变基因的正确DNA序列 。 小鼠的每250个肝脏细胞中 , 就有1个插入了正确的基因 。 接下来一个月 , 被“修正”的肝脏细胞蓬勃生长 , 最终取代了1/3的病变细胞——这足以使小鼠摆脱上述疾病 。 2014年8月 , 坦普尔大学(Temple University)的病毒学家卡迈勒·哈利利(Kamel Khalili)领导的研究人员报道 , 他们已经用CRISPR在数个人类细胞系中对HIV病毒进行了剪切 。
自上世纪80年代起 , 哈利利一直奋战在对抗HIV/AIDS的前线 。 对他来说 , CRISPR是场不折不扣的革命 。 尽管艾滋病治疗已经取得了巨大的进步 , 但今天的药物仅仅能控制病毒 , 仍然不能根除疾病 。 不过 , 运用CRISPR , 哈利利团队已经彻底从细胞中清除了HIV的完整DNA拷贝 , 将受感染的细胞转化了成无病毒细胞 。 并且 , 除了“清洗”已经感染病毒的细胞 , CRISPR还可以将一段病毒序列整合进未受感染的细胞中 , 对其进行免疫——正如杜德娜和她的团队在原始的细菌中观察到的那样 。 你可以将这种手段称作“基因疫苗” 。 哈利利说:“这是终极的治疗方法 , 如果你在两年前问我 , ‘你能精准地切割人类细胞中的HIV吗?’我可能会说这非常困难 。 但现在 , 我们做到了 。 ”
本文由微信公众号“环球科学”(ID:huanqiukexue)授权转载
转载请先联系newmedia@huanqiukexue.com
【crispr|诺贝尔化学奖授予CRISPR研究!两位女性科学家获奖】编辑:Shiny
- 诺贝尔|孩子问诺贝尔奖成果有多牛?影响人类生活的十大诺奖成果,一定要讲给孩子|特别关注
- 丙肝|他们发现了丙肝病毒!三位科学家荣获2020年诺贝尔生理学或医学奖
- 人工智能|厦大成立人工智能研究院,欲加强AI与经济化学等学科交融
- 爱因斯坦|学霸!诺贝尔奖官方公布爱因斯坦高中成绩单
- 实践|2020四川省高校化学专业创新创业教育改革与实践研讨会在成都师院举行
- 二年前贺建奎判刑的基因编辑获诺贝尔奖
- 阎连科得诺奖只是早晚的问题
- 诺贝尔奖119年没发完,我国大学该学什么?
- 去哪玩|初中化学, 必背知识点收拾整顿, 你必定需要
- 去哪玩|数学不好?诺贝尔奖宣布爱因斯坦成绩单:高中是个学霸,文理俱佳
