按关键词阅读:
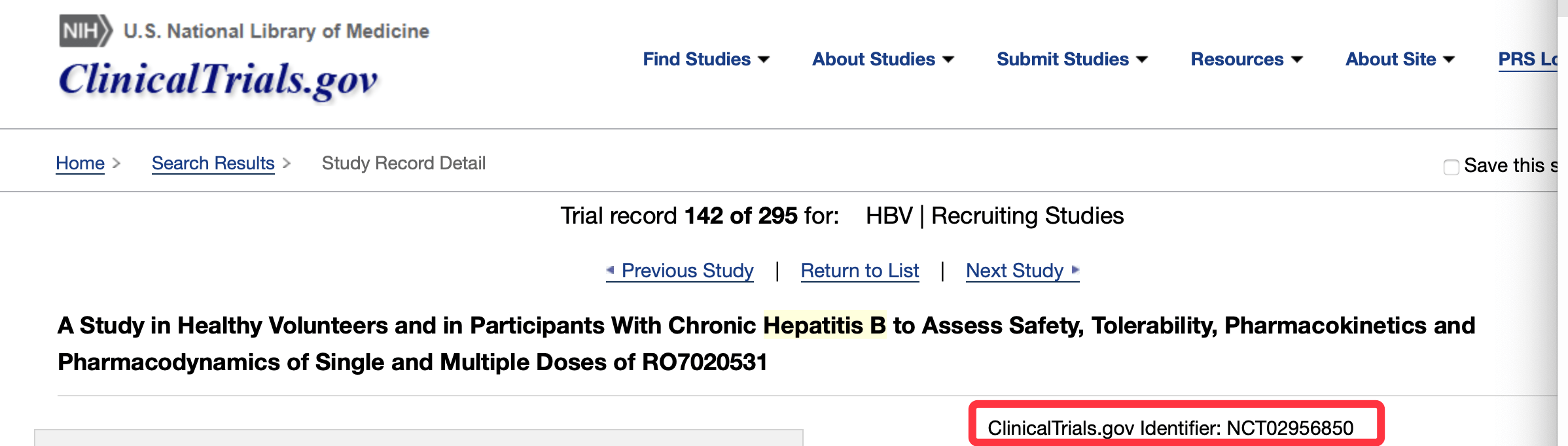
瑞士罗氏制药启动在健康志愿者和慢性乙肝参与者中评估单剂量和多剂量RO7020531的安全性、耐受性、药代动力学和药效学研究 。 本项人体临床试验在2020年8月11日更新一次 , 临床试验编号:NCT02956850(见下图) 。
文章图片
乙肝在研新药RO7020531 , 罗氏制药研发 , I期明年初完成
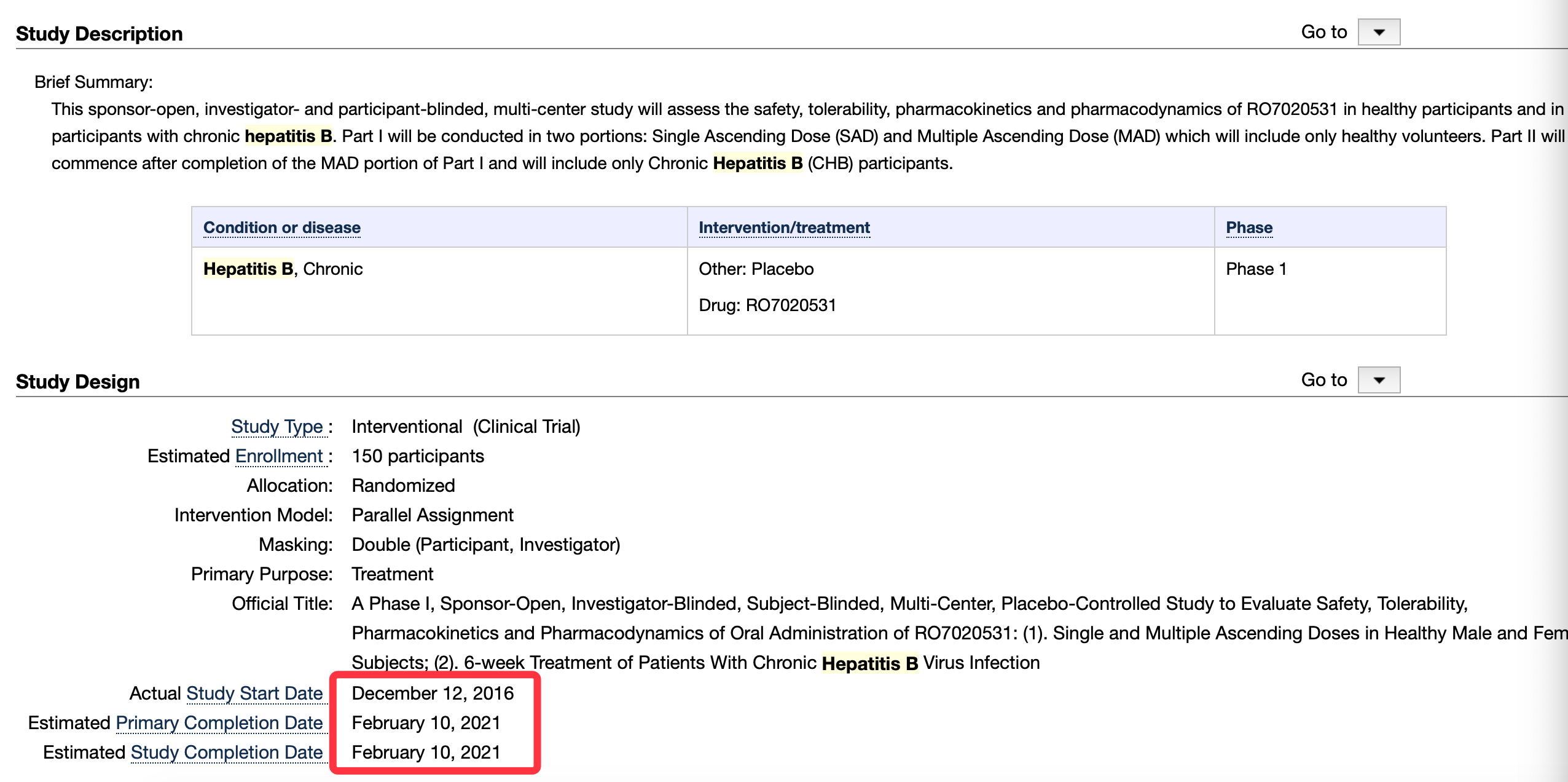
根据全球临床试验数据库登记 , 罗氏的乙肝在研新药RO7020531已经启动I期临床 , 主要在健康受试者和慢性乙肝(CHB)中进行 。 RO7020531的I期临床试验的第一部分将分为2个部分进行:单次递增剂量(SAD)和多次递增剂量(MAD) , 仅包括健康志愿者;第二部分将在完成第一部分的MAD部分后开始 , 只包括慢性乙肝(CHB)受试者 。
I期招募150名受试者 , 是一项开放、双盲(研究者盲 , 受试者盲)、多中心、安慰剂对照研究 , 评价口服乙肝在研新药RO7020531的安全性、耐受性、药代动力学和药效学:(1) 。 此外 , 健康受试者的男性或女性单次和多次递增剂量 。 慢性乙肝病毒感染的6周治疗 。I期临床开始时间:2016年12月12日 , 预计初步完成时间:2021年2月10日 。
文章图片
实验:第一部分:健康志愿者将在每个队列的第1天到第13天 , 口服单剂量的RO7020531或匹配的安慰剂 。 SAD的计划剂量递增顺序为3毫克、10毫克、20毫克、40毫克、60毫克、100毫克、140毫克以及170毫克 。 其他:安慰剂与RO7020531相匹配的安慰剂将按照各自arm中规定的时间表进行给药 。 实验:第二部分:社区卫生局参与者 , 从第1天到第41天 , 慢性乙肝受试者接受RO7020531(根据MAD队列的安全性、PK和PD数据选择的剂量)或匹配的安慰剂口服 。 其他:安慰剂 与RO7020531相匹配的安慰剂将按照各自arm中规定的时间表进行给药 。
入选标准:RO7020531的I期临床试验接受健康志愿者 , 18至65岁成人或老年人 。 第一部分:健康志愿者 , 体重指数(BMI)介于18至32千克/平方米(kg/m^2)之间 , 包括不吸烟者或每日使用少于10支香烟(或同等含尼古丁产品)抗核抗体(ANA)阴性;或稀释度不大于1:40且无相关病史或潜在结缔组织疾病或其他免疫介导疾病症状的阳性;

文章图片
第二部分:慢性乙肝参与者BMI在18至32 kg/m^2(含)之间慢性乙肝病毒感染(随机分组前 , 乙肝表面抗原检测阳性持续6个月以上)队列1、2、3、4:筛查时 , 可以检测到乙肝表面抗原对队列1、2、3随机分组前至少6个月内HBV-DNA小于90 IU/mL;使用Roche-Cobas法筛选时 , HBV-DNA小于90 IU/mL;队列4:乙肝e抗原阳性的HBV-DNA筛查大于或等于2×10*4IU/mL , 乙肝e抗原阴性参与者筛查时 , HBV-DNA大于或等于2×10*3IU/mL;
随机分组前6个月内队列1、2、3的丙氨酸氨基转移酶(ALT)=<1.5×正常上限(ULN) , 两次测量间隔至少14天;筛查时的ALT=<1.5×ULN 。 对于队列4:筛查和第1天就诊时的ALT和AST:小于或等于5×ULN 。 抗核抗体试验阴性;或稀释度不超过1:40且无潜在结缔组织疾病或其他免疫介导疾病的相关病史或症状的阳性;随机分组前6个月内 , 肝脏活检、Fibroscan?或等效弹性成像试验 , 证明肝病与慢性HBV感染一致 , 无肝硬化和广泛桥联纤维化(肝硬化或广泛桥联纤维化定义为大于或等于(>/=)Metavir 3 , Fibroscan 8.5千帕[kPa]的建议截止值;队列1、2和3:使用替诺福韦、恩替卡韦、阿德福韦或替比夫定 , 单药或联合用药 , 至少6个月;队列4:过去6个月内 , 乙肝病毒(HBV)治疗未接受任何抗HBV治疗 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn09139235052020.html
标题:乙肝|乙肝在研新药RO7020531,罗氏制药研发,I期明年初完成
