按关键词阅读:
内源性或转移的细胞毒性T细胞是抗肿瘤免疫的基本介质 , 持续的抗原暴露会使T细胞逐渐变成衰竭状态 。 了解如何防止T细胞衰竭 , 从而扩展其功能是目前免疫肿瘤学中最紧迫的问题之一 。
造血祖细胞激酶1(HPK1)是一种免疫抑制调节激酶 , 也是一种T细胞受体(TCR)的负调节因子 , 会破坏TCR信号复合体的稳定性 。 先前的研究表明 , HPK1激酶可以抑制多种细胞的免疫功能 , 而灭活其结构域足以引发抗肿瘤免疫反应效应 。 这表明 , HPK1是一个很有前途的肿瘤免疫治疗的候选靶点 。
2020年8月28日 , 清华大学廖学斌课题组与中山大学魏来课题组合作, 揭示了HPK1介导T细胞功能障碍 , 并且是T细胞免疫疗法的药物靶标 。 相关成果发表在《Cancer cell》上 。

文章图片
https://doi.org/10.1016/j.ccell.2020.08.001
在之前的研究中 , 研究人员已经证实 , 在25种不同类型癌症的肿瘤浸润性T细胞中 , 抑制性PDCD1(编码PD-1)受体和MAP4K1(编码HPK1)之间存在强烈的正相关关系 。 现通过进一步检测MAP4K1与肿瘤浸润性T细胞中的其他抑制性受体的相关性发现 , 不同癌症患者的MAP4K1与T细胞衰竭信号(CD3E、TIGIT、PDCD1、CTLA4、HAVCR2和LAG3)呈正相关 , 而检测患者肿瘤标本中抑制受体和HPK1的蛋白表达时也发现衰竭T细胞中HPK1表达上调 。 这些结果证实了HPK1与肿瘤浸润性T细胞耗竭呈正相关 , 提示HPK1可能是调节T细胞耗竭和抑制抗肿瘤免疫反应的关键激酶 。
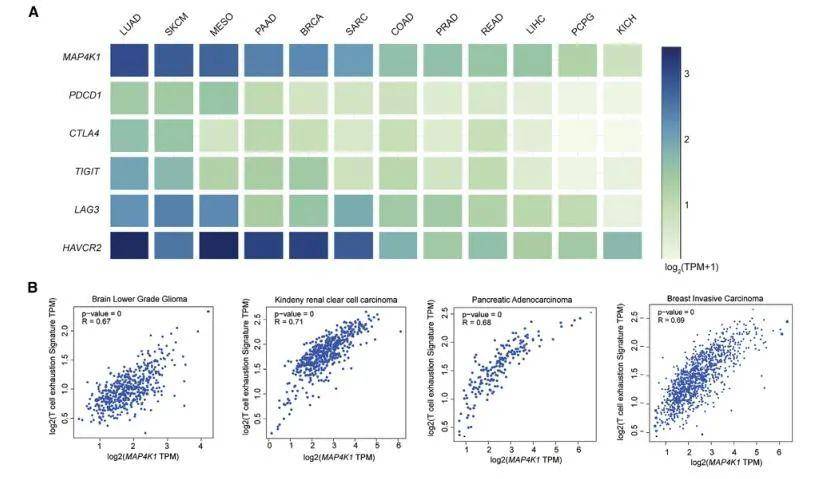
文章图片
不同癌症患者的MAP4K1表达及与T细胞衰竭信号相关性
为了进一步验证HPK1对T细胞的抗肿瘤活性或肿瘤细胞生长的影响 , 研究人员检测了HPK1在肿瘤细胞中的表达 , 发现HPK1在肿瘤细胞中很少表达 。 研究人员采用B16OVA模型 , 发现与野生小鼠相比 , MAP4K1细胞中OVA特异性CD8+肿瘤浸润淋巴细胞(TILs)的数量增加 , MAP4K1缺陷小鼠表现出脱颗粒标记物CD107a的表达增加 , 并在佛波醇PMA和离子霉素刺激下产生更多的颗粒酶B和干扰素-g(IFN-g) 。 因此 ,MAP4K1缺失的CD8+TILs不仅能减少衰竭 , 而且具有较强的抗肿瘤活性 。
之后研究人员进行相关机制研究 , 发现HPK1-Blimp1轴可驱动CD8+直到耗尽 。 研究人员先分析了肿瘤浸润性T细胞的RNA序列数据 , 发现HPK1基因敲除引起共抑制受体(如PDCD1、HAVCR2、LAG-3和CTLA-4)和凋亡相关基因(如ANXA1、FAS、BCL2L2、CASP3、CASP1和CASP4)的下调 , 细胞周期相关基因的上调(例如 , GADD45B、CDKN2A、CDK2、CCNB1、MAD1L1、TFDP1、CDC25B和CDC25C) , 而小鼠体内蛋白表达水平也证实了该结果 。
此外 , 在黑色素瘤患者中 , PRDM1(编码Blimp 1)和TOX与MAP4K1呈显著正相关 。 先前的研究证明 , HPK1作为一种关键的TCR近端激酶发挥作用 , 其通过阳性细胞调节肿瘤浸润性T细胞衰竭Blimp1表达对T细胞活化进行调控 , 而本研究中的一系列实验也证实了这一结果 。
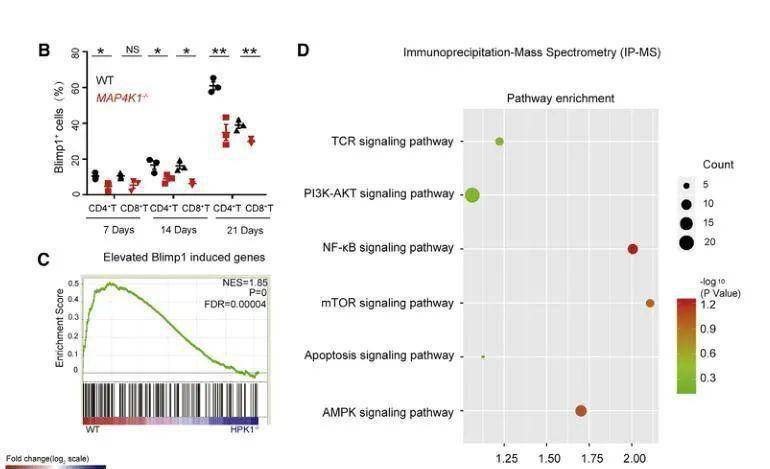
文章图片
HPK1-Blimp1轴及HPK1与其他信号通路之间的相互作用
之后 , 研究人员进一步探讨了HPK1对嵌合抗原受体(CAR-T)细胞功能的影响 。 他们发现 , 与敲除了PD-1的 CAR-T细胞相比, 敲除MAP4K1的 CAR-T细胞对肿瘤细胞的毒性显著增强 。
接下来 , 研究人员采用患者衍生的MM NSG小鼠模型 , 评估MAP4K1敲除的CAR-T细胞的临床前疗效和安全性 。 结果显示 , 与对照组相比 , 在体外培养的第7天 , MAP4K1敲除的B细胞成熟抗原CAR-T细胞中TOX和GATA3的表达降低 , TCF1的表达增加 。 此外 , 其可显著抑制肿瘤生长并延长小鼠存活期 。 与对照组相比 , 这种细胞显著产生的并不是更高的IL-6 , 而是更高的IFN-g和更少的IL-15 , 而且毒性更小 。 这些结果表明 , 敲除MAP4K1的CAR-T细胞明显地平衡了安全性和有效性 。 
稿源:(健康界)
【】网址:http://www.shadafang.com/c/hn091191X392020.html
标题:调节|原来T细胞也会“衰老”,中国科学家揭示调节T细胞衰竭的关键激酶
