每年至少造成4万人失明,病毒性角膜炎复发致盲难题有了新突破口
 文章插图
文章插图
蔡宇伽(右)与洪佳旭
病毒性角膜炎复发致盲的难题有了新突破口 。 近日 , 上海交通大学系统生物医学研究院蔡宇伽教授和复旦大学附属眼耳鼻喉科医院洪佳旭副主任医师合作在基因编辑治疗领域取得重要突破 。 相关成果和操作技术在国际顶尖学术期刊《自然-生物医学工程》和《自然-生物技术》杂志接连发表 。
 文章插图
文章插图
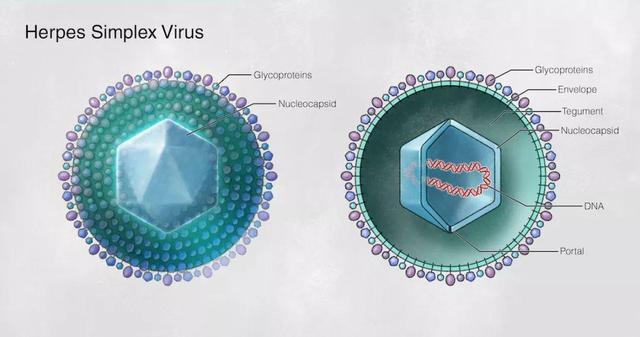
单纯疱疹病毒(HSV)是人类最常见的病原体 , 在人群中的感染极为普遍 , 至今是尚未被攻克的医学难题——既无疫苗可用 , 也无药物可以根治 。
 文章插图
文章插图
HSV病毒
HSV根据抗原特性不同可分为HSV-1和HSV-2两种血清型 。 HSV-1的感染可引起多种疾病 。 若眼角膜被HSV-1感染 , 会引起疱疹性基质性角膜炎(HSK) , 成为导致感染性失明的首要原因 。
部分病毒性角膜炎患者能通过接收角膜移植恢复透明 , 但危机并未解除 。 在全球范围内 , 估计每年有150万个角膜HSV复发案例 , 至少造成4万人失明 。
“失而复得 , 得而复失” , 如何在保证安全的基础上 , 直接降解病毒的基因组 , 甚至从根源上“剔”除潜伏的HSV , 就成了亟待解决的问题 。
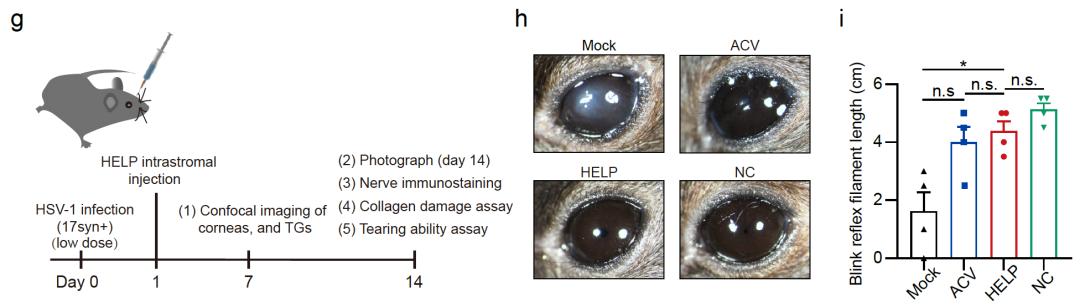
该研究团队通过基因编辑和递送技术的融合 , 全球首创基因治疗递送载体——类病毒体-mRNA(VLP-mRNA) , 并利用该递送技术进行了CRISPR基因编辑治疗病毒性角膜炎的临床前研究 , 在急性和复发感染的小鼠模型中实现了从角膜到三叉神经节的逆行运输 , 终于将潜藏在神经节的HSV-1病毒库清除 。
该项治疗技术的英文全称是“HSV-1-ErasingLentiviralParticles” , 于是 , 研究团队将其命名为“HELP” , 即“帮助” , 期待这种全新的抗病毒疗法能够帮助难治性病毒性角膜炎患者 , 给他们有机会重获光明 。
随着基因编辑工具的不断发展 , 如何将这些工具更好地递送进入病灶内 , 并降低这些工具在细胞中产生的长期风险 , 成为基因治疗领域日益凸显的新挑战 。 研究团队此次开发的新技术 , 创新性地将病毒颗粒(VLP)和基因编辑工具的递送结合起来 , 在病毒性角膜性的动物模型中实现了有效且安全的基因编辑 。
 文章插图
文章插图
HELP在病毒感染的治疗模型上的治疗效果展示
“不仅解决了传统递送平台存在的尺寸限制 , 且将基因编辑工具的表达载体由长期存在的DNA替换成了瞬时表达的mRNA , 极大提高了工具使用的灵活性和安全性 。 ”特邀评论员、阿斯利康(瑞典)基因治疗项目高级科学家李松沅博士总结道 。
病毒性角膜炎并非无药可医 , 但无论是阿昔洛韦(ACV)等小分子抗病毒药物 , 还是角膜移植 , 都无法对潜伏的疱疹病毒库起到任何限制作用 , 使其成为难以根治之症 。 该项研究便为此类顽疾提供了全新的解决思路 。
作为我国首个基因治疗方面的原创性抗病毒新技术 , 从细胞水平研究到动物水平研究 , 再到捐献者角膜研究 , 都实现了步骤完备、论证可靠的临床前研究 。 HELP技术以mRNA的形式完成CRISPR/Cas9的工具递送 , 使得基因编辑酶Cas9在体内的停留时间很短 , 可最大限度地降低脱靶风险、减少免疫反应 。
正如特邀评论员、中山大学中山眼科中心副主任袁进教授所言 , 将基因编辑运用于单疱病毒性角膜炎的治疗是从0到1的创新突破 。 该研究证实 , 在单疱病毒性角膜炎动物模型上通过基因编辑可抑制HSV病毒的转运和复制 , 有希望成为一种病毒性角膜炎的全新疗法 , 解决病毒性角膜炎复发这一临床难题 。 ”
- 笑傲江湖令狐冲一手造成了五岳剑派没落
- 想不到张艺谋已经七十岁了,每天工作到凌晨五点,每年一部电影
- 郑爽“代孕弃养”事件背后真相:父母的格局,造成了郑爽的任性
- 每年新增80万肺癌患者!要想肺更好,劝你多吃3物,少做3事
- 三生三世:阿离墨渊被劫持,白浅为何打不过玄女?至少有3个原因
- 肖战没希望返回吗?新综艺节目,被怀疑是“一剪没”
- 晚上|造成夜晚失眠的原因一览:有时与你太关注睡觉本身有关
- 从DNA到激素,喝酒过多对你身体造成的5种危害
- 已接种HPV疫苗,还能接种新冠疫苗吗?中疾控专家:不建议同时接种 间隔至少两周以上
- 假期孩子扎堆整牙 6—15岁儿童应每年做一次牙齿检查
