2020最新获批的PD-1/L1疗法汇总?(囊括13类癌症)( 二 )
TMB-H实体瘤2020年6月16日 , FDA批准pembrolizumab治疗具有高组织肿瘤突变负荷(TMB-H)≥10个突变/兆碱基(使用FDA指定的检测)的无法切除或转移性实体瘤的成年和儿科患者 。 批准是基于来自II期临床试验的数据 , 使用pembrolizumab治疗可使30%的具有不可切除或转移性肿瘤缩小 。 原文链接:批了!Keytruda第二项不限癌种适应症获批上市!
皮肤癌2020年6月24日 , FDA批准pembrolizumab用于皮肤鳞状细胞癌治疗 , 此次批准是基于一项II期临床试验的结果 , 该研究表明 , 接受免疫治疗的患者中有34%的患者肿瘤完全或部分缩小 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
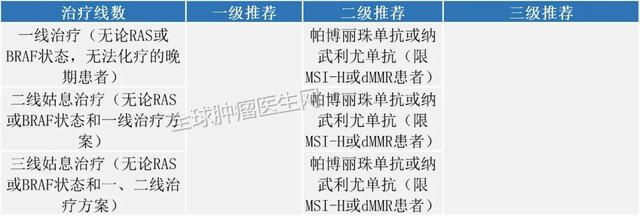
MSI-H结直肠癌2020年6月29日 , FDA批准使用派姆单抗(KEYTRUDA , Merck&Co.)作为一线治疗不可切除或转移性微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)大肠癌的患者 , 该批准基于II期临床试验的结果 , 该结果表明 , 与接受标准治疗的患者相比 , 接受pembrolizumab的患者疾病进展之前的时间几乎翻了一番 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
尿路上皮癌2020年6月30日 , FDA批准avelumab(BAVENCIO)用于接受一线含铂化疗 , 病情尚未进展的局部晚期或转移性尿路上皮癌(UC)维持治疗 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
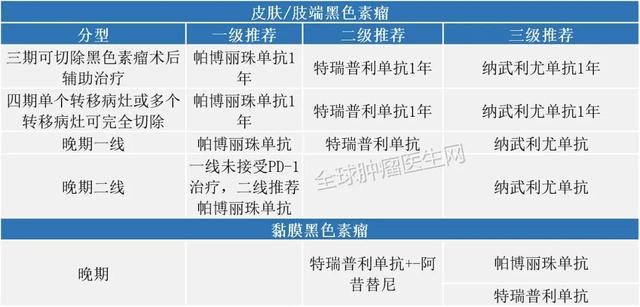
黑色素瘤2020年7月30日 , FDA批准atezolizumab联合cobimetinib(Cotellic)和vemurafenib(Zelboraf)治疗BRAF V600阳性的黑色素瘤 。 批准是基于一项III期临床试验的结果 , 该研究表明 , 将atezolizumab添加到cobimetinib和vemurafenib中会显着增加疾病进展的时间 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
间皮瘤2020年10月2日 , FDA批准了将nivolumab(OPDIVO , Bristol-Myers Squibb Co.)与ipilimumab(YERVOY , Bristol-Myers Squibb Co.)联合用于成人不可切除的恶性胸膜间皮瘤患者 。
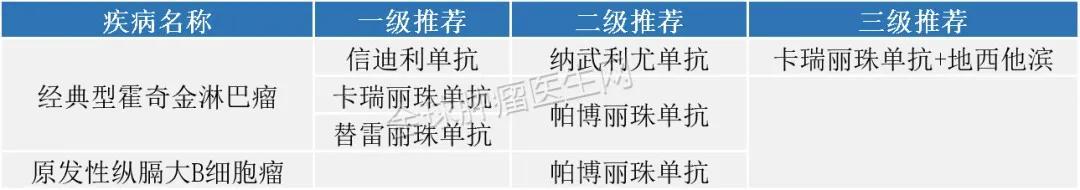
淋巴瘤2020年10月14日 , FDA扩大了派姆单抗(KEYTRUDA? , Merck Sharp&Dohme Corp.)的批准 , 用于以下适应症:
成人复发或难治性经典霍奇金淋巴瘤(cHL)和患有难治性cHL的儿童患者 , 或在2线或以上治疗后复发的cHL 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
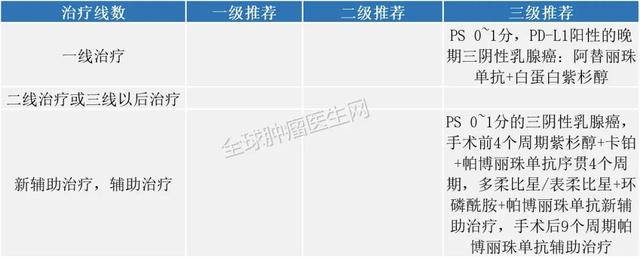
三阴乳腺癌2020年11月13日 , FDA加快批准pembrolizumab(KEYTRUDA , Merck&Co.)联合化疗 , 用于治疗肿瘤表达PD-L1(CPS≥10)的局部复发性不可切除或转移性三阴性乳腺癌(TNBC)患者) 。
2020版CSCO免疫检查点抑制剂临床应用指南:
 文章插图
文章插图
免疫治疗崛起!全球新一代PD-1/L1药物百花齐放目前全球已经获批上市了十款PD-1/L1 , 除此之外 , 针对PD-1 / PD-L1途径的几十种新一代免疫检查点抑制剂正在火热开发中 , 见表一 。
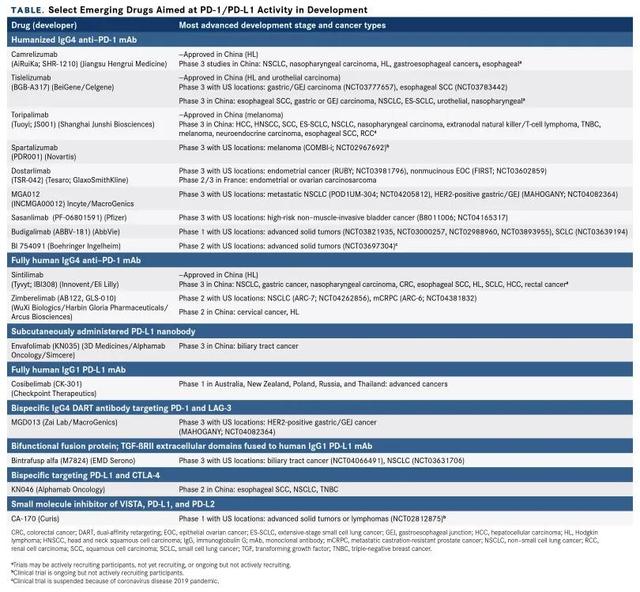 文章插图
文章插图
根据最近的一项分析 , 截至2019年9月 , 全球近3000项PD-1 / PD-L1抑制剂临床试验正在招募 , 超过50万患者登记 。 值得振奋的是 , 近两年 , 我国的生物技术公司在该领域也非常活跃 。 除了来自国际制药公司的药物外 , 中国监管机构还批准了4种在国内开发的PD-1抑制剂 , 还有4-8种和其他几种新疗法正在后期临床测试中 。
- 三次回应不提弃养,最新录音要再次代孕?PUA大师郑爽早有打算
- 谢娜最新孕照曝光,衣着宽松腹部微隆,双手捂脸显俏皮
- 45岁的李小冉最新生图曝光,穿凉鞋鱼尾纹可见,岁月痕迹初现
- 肖战王一博越长越像?最新动态撞脸太明显,真爱粉差点都认不出
- 西安该医院最新通告:发热患儿不能预约
- 晚期癌症=死亡?三大抗癌领域最新进展
- 最新糖尿病标准已经修改,这4项诊断依据,希望你一个都不符合
- 安徽中医药大学第二附属医院获批第三批安徽省临床医学研究中心 - 安徽 - 安徽财经网
- 1月19蚂蚁庄园今日答案最新:嗑瓜子时如果吃到带苦味的瓜子 最好怎么做?
- 周刊少年JUMP最新封面公开,本次封面为Dr.STONE石纪元
