权威解读:EGFR敏感突变肺癌靶向治疗原发耐药的机制及临床对策( 五 )
 文章插图
文章插图
3.3 针对合并共突变的对策
3.3.1 针对明确靶点:联合靶向药物
对于EGFR敏感突变合并CDK4/6基因或MET扩增的原发耐药患者 , EGFR-TKIs联合CDK4/6抑制剂或MET抑制剂的双靶向药治疗模式将有潜力成为未来的一线治疗选择 。
3.3.2 针对BIM缺失:联合化疗 , 或其他传统药物
对于EGFR敏感突变合并BIM缺失多态性的NSCLC患者采用EGFR-TKIs联合化疗作为一线治疗的中位PFS显著优于EGFR-TKIs单药治疗 , 因此在BIM缺失的患者中 , EGFR-TKIs联合其他传统药物治疗可能成为改善原发耐药的新方法 。
3.3.3 针对共突变:联合多靶点EGFR-TKIs
多靶点EGFR-TKIs如抗血管生成药物被证实有良好的协同抗肿瘤作用 , 并且与EGFR-TKIs联用可显著延长EGFR敏感突变患者的PFS 。
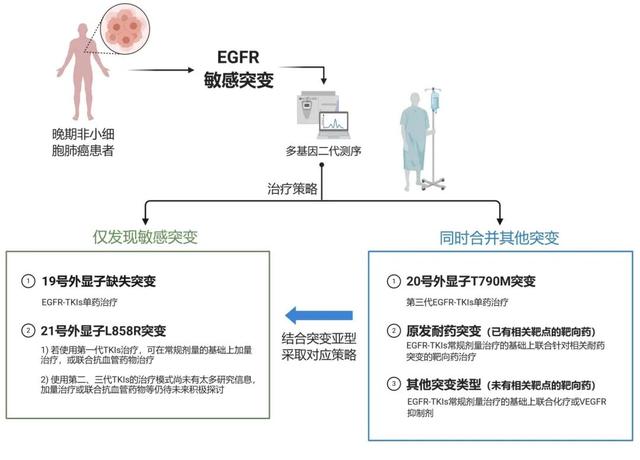
四、EGFR敏感突变的诊疗策略路径
结合EGFR敏感突变原发耐药机制及对策 , 提出了基于目前认知的精细化诊疗策略路径 , 通过使用精准的治疗手段减少原发耐药的影响 。 见图1 。
 文章插图
文章插图
注:EGFR=表皮生长因子受体;TKIs=酪氨酸激酶抑制剂;L858R=858号亮氨酸突变为精氨酸;T790M=790号苏氨酸突变为甲硫氨酸;VEGFR=血管内皮生长因子受体
图1 EGFR敏感突变的精细化诊疗策略路径
五、未来发展的方向
上述关于EGFR敏感突变的认知和治疗策略仅为阶段性 , 根据其生物学特性进行推理 , 结合目前正在进行的研究 , 提出以下几个将来需要解决的问题及发展方向 。
 文章插图
文章插图
5.1 明确不同共突变的具体影响及各种原发耐药机制的最优治疗模式
尽管目前普遍认为合并其他基因突变是原发耐药的主要机制之一 , 但具体突变基因及突变位点的功能及影响仍存在大量未知 。 随着多基因二代测序在临床中的普及 , 将会有越来越多的数据积累 , 由于部分突变并非高频 , 细分至具体突变位点更是数量繁多 , 因此未来应该通过多中心协作 , 打破数据孤岛 , 进行大量的融合汇总分析 , 以探索各种突变基因及突变位点对原发耐药的影响 , 并总结归纳出对应的最优治疗模式 。
 文章插图
文章插图
5.2 “鸡尾酒”思路
由于大部分具体突变基因及突变位点的意义未明 , 并没有针对性的靶向治疗方案 , 而且暂未能开发出精准的治疗对策 , 要充分利用不同类型药物的互补特性 , 进行“鸡尾酒”式的联合治疗或许是目前增加生存获益的最佳选择 。 尤其随着各种药物毒性的普遍下降 , 不同药物的叠加毒性仍在可控范围 , 不会影响患者接受治疗的耐受性 。
 文章插图
文章插图
5.3 运用ct-DNA动态监测指导治疗策略
ct-DNA动态监测在用药过程中检测耐药突变基因负荷 , 评估靶向药物敏感性 , 监测用药后/稳定期患者疾病进展风险 , 以及动态描述肿瘤组织的分子学异质性等 , 从而更加精准地选择需要联合治疗的患者 , 对促进患者全程、靶向精细管理有着重要价值 。
 文章插图
文章插图
5.4 联合免疫治疗
免疫治疗已经成为NSCLC的主要治疗之一 , 但既往单药治疗EGFR敏感突变患者疗效欠佳 , 因此目前并未推荐PD-1/PD-L1单独用于EGFR敏感突变患者 。 因EGFR敏感突变患者肿瘤微环境(TME)不利于免疫激活 , 所以应考虑针对TME的复杂性制定出多模式的治疗方案 , 主要包括抑制CD73、抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)及针对化疗后TME重塑的改造等 。 由于肿瘤的异质性及TME的复杂性 , 单药治疗或单个疗效标志物均有各自的局限性 , 联合疗法、免疫检查点抑制剂联合化疗在临床前和临床研究中表现出了协同效应 , 成为目前探索的主要方向 。 但是临床上仍有一系列问题亟需解决 , 主要包括评估及控制化疗联合免疫治疗的不良反应 , 减少联合毒副作用;如何优化治疗剂量及给药顺序;如何筛选合适的患者接受化疗联合免疫治疗等 。 探索免疫微环境转变的生物标志物及靶点 , 包括仍有待突破的CAR-T、TCR-T、细胞因子过继疗法等 。 结合个体化免疫治疗 , 建立多模式治疗方案 , 实现真正合理的联合策略 。
- 尿酸高的权威指导来了
- 导致|专家解读:冬季眼睛睁不开,可能是空调地暖惹的祸?
- 权威发布:这些酸菜、酱腌菜都被检出防腐剂超标,不吃也罢
- 【权威发布】祝贺!中大医院新增8个省级临床重点专科!
- 喝咖啡能瘦身?日常该怎么喝?为您解读咖啡的健康价值
- 肺癌医学权威吴一龙周三直播开讲肺癌慢病化离我们有多远
- 权威发布:山东这些韭菜、鸡蛋都被检出大问题,当心被坑
- 吃得多不如吃得好!权威发布:这么吃,才是适合中国人的长寿饮食
- 有趣有料有用,权威科普新主张!齐鲁晚报健康视频号上线啦
- 查糖化血红蛋白,能否诊断糖尿病?能代替血糖吗?医生3方面解读
