按关键词阅读:
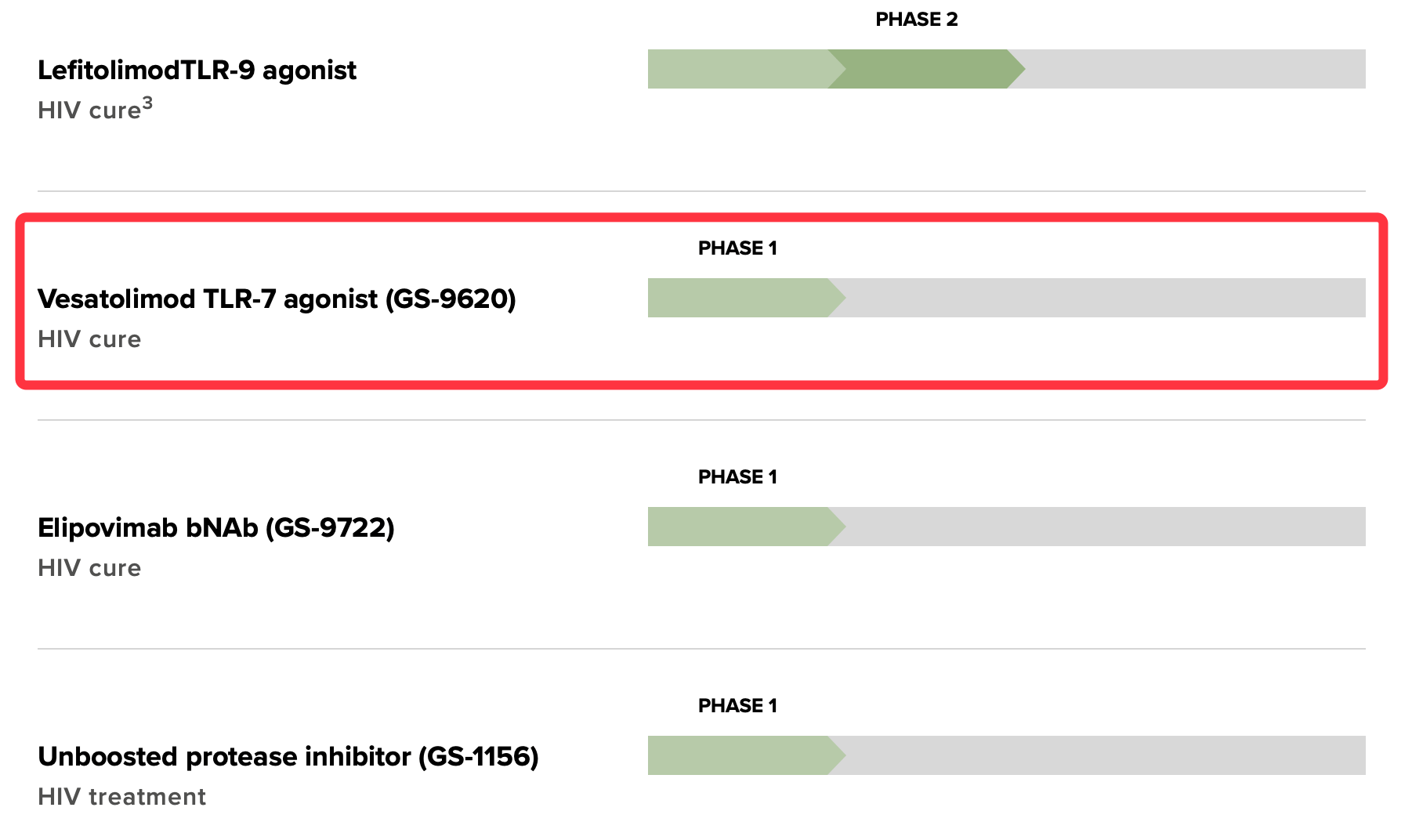
激活人体先天免疫反应的干预措施 , 是全球开发乙肝潜在新靶点新机制 。 比如 , Toll样受体激动剂 。 Toll样受体(Toll-like receptors , tlr) , 它已经被药物学家证明是抵御微生物入侵的第一道防线 , 全球有多家药企基于Toll样受体激动剂开发新药当中(下图:来源吉利德科学新药研发管线) 。
文章图片
乙肝在研新药GS9620 , 显示持久抑制 , 但cccDNA未下降
该靶点主要通过信号转导途径来感知病原体相关的分子模式 , 从而产生细胞因子 。 TLR-7和TLR-8激动剂 , 参与内源性IFN刺激基因的诱导以及JAK/STAT通路等其他信号级联的激活 。 吉利德科学的TLR-7激动剂GS-9620 , 首次在人类肝细胞系HepaRG和感染HBV的原代肝细胞中进行测试时 , 通过诱导I型IFN , 显示了对乙肝病毒复制的持久抑制 , 但cccDNA水平没有下降(许多抗HBV药物同时也为抗HIV药物) 。
而在土拨鼠和黑猩猩动物模型试验中 , 研究人员也观察到类似的结果 , 但当应用于核苷酸类似物(NA)治疗抑制慢性乙肝患者时 , 对乙肝表面抗原水平没有显著的影响 。 另一种TLR-7激动剂(RO7020531)和衣壳组装调节剂RO7049389的联合治疗后 , 感染重组腺相关病毒(AAV-HBV感染小鼠模型)的小鼠的HBV-DNA和表面抗原水平显著下降 。
【显示|乙肝在研新药GS9620,显示持久抑制,但cccDNA未下降】
文章图片
这种RO7020531+RO7049389的联合治疗在中国健康志愿者中 , 单次和多次递增剂量 , 能够导致IFN-a诱导的细胞因子产生和ISG的诱导 。 未来它与其他抗病毒药物联合使用的疗效仍有待确定 。 总体上 , 这种基于免疫疗法开发新靶点分支 , 激活先天免疫反应的干预措施主要有Toll样受体激动剂 , 动物模型证明 , 单药对cccDNA和表面抗原没有影响 , 但在药物联用方面 , 已观察到免疫疗法分支TLR-7激动剂联合衣壳组装调节剂 , 实现了动物模型时 , 对HBVDNA及乙肝表面抗原明显调降作用 。
另一种免疫疗法开发新靶点分支是 , 维甲酸诱导基因-1(RIG-I)激动剂 , 其也属于新型的免疫疗法 。 RIG-I是一种胞浆内PAMP受体 , 与RNA病毒的双链RNA相互作用 。 一旦被激活 , 它可以通过蛋白激酶复合物和NFκB和IRF3转录因子的激活 , 而导致信号转导 , 这些转录因子又迁移到细胞核 , 能够激活ISG , 从而产生IFN-a和其他细胞因子 , 从而启动抗病毒免疫 。
文章图片
最近在发表在临床医学杂志期刊上 , 研究人员注意到一些报道称 , pgRNA中存在的epsilon包封信号被RIG-I识别 , 导致产生III型IFN而不是I型IFN 。 此外 , 人们注意到RIG-I抵消了epsilon与乙肝病毒聚合酶的相互作用 , 从而抑制乙肝病毒复制 。 虽然 , 在研乙肝新药SB 9200已被终止研发 , 但前期证明它是一种RIG-I/NOD-2激动剂 。
在SB 9200研究中 , 指的是评价其对慢性乙肝病毒感染者的安全性、药代动力学和抗病毒疗效研究时 , 纳入了80名未经治疗的非肝硬化慢性乙肝患者 。 这些患者被随机分为12周治疗 , 接受从25毫克到200毫克的递增剂量的SB 9200或安慰剂 , 然后再转为TDF治疗12周 。 负责这些研究人员观察到 , 80名e抗原阳性患者(大三阳)和e抗原阴性患者(小三阳)的HBV-DNA和RNA的减少均呈剂量依赖性 , 而后者更大 。
22%的患者在12周或24周时 , 乙肝表面抗原水平下降大于0.5log10 。 但是 , 最近SB 9200在进行400毫克剂量与TDF进一步研究时已经被研究人员终止开发 。 目前看来 , 基于免疫疗法开发乙肝新药难度更高于其他靶点 , 如衣壳抑制剂、RNAi、乙肝表面抗原抑制剂、反义寡核苷酸等等 。 因此 , 在新型免疫疗法开发研究药物中 , 也较其他研究药物更为频繁的报道研发终止的报道 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn110Yb4122020.html
标题:显示|乙肝在研新药GS9620,显示持久抑制,但cccDNA未下降
