按关键词阅读:
乙肝表面抗原释放抑制剂是新药研发的可行靶点之一 。 因为药物化学家发现 , 乙肝表面抗原对乙肝病毒感染具有重要的抑制作用 , 已经被证明表面抗原能够阻断适应性和先天性免疫机制 。 因此 , 当前肝病领域研究人员把功能性治愈主要方向放在 , 从慢性乙肝患者血清中清除乙肝表面抗原 , 进而消除这种免疫抑制 。

文章图片
乙肝在研新药REP2165 , 401研究 , 41%实现功能性治愈
乙肝表面抗原若能够清除即阴转后 , 就能够克服自己免疫不作为或称之为T细胞衰竭 。 全球基于乙肝表面抗原释放抑制剂的在研乙肝新药中 , 具有代表性的是包含REP-2055、REP-2139和REP-2165化合物 。 此前 , 这些化合物已经被证明 , 可以阻止感染肝细胞释放乙肝表面抗原 。 在REP 301和REP 301-LTF试验中 , 12名HBV/HDV共同感染者接受了500毫克REP 2139 Ca静脉注射 , 每周1次 , 持续15周;
随后再用250毫克REP 2139和Peg IFN-α联合治疗 , 每周1次 , 持续15周 , 然而单独使用Peg IFN-α治疗33周 。 REP 2139的治疗 , 最终导致42%的受试者迅速有效地清除了乙肝表面抗原 , 并使血清转化为抗-HBs , 即不仅实现乙肝表面抗原阴转 , 还伴有乙肝表面抗体出现 。 负责研发REP 2139化合物的研究人员还介绍 , 这种乙肝表面抗原血清转化在停止治疗后还可以持续维持(下图:来自Replicor公司研发管线 REP 2139或REP-2165已进入第2期临床研究) 。
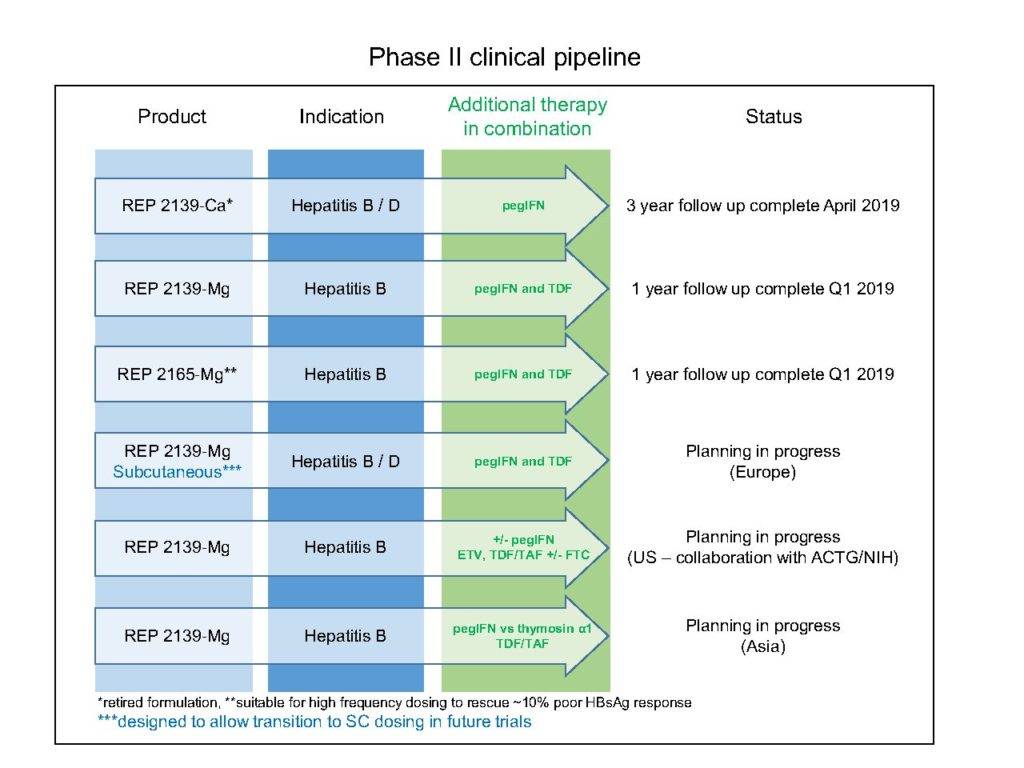
文章图片
尽管REP 2139 Ca已经被证明对人体是安全性的 , 但在反复给药的情况下 , 它还是会积聚在肝脏中 。 因此 , 研究人员又设计了REP 2165 , 它是REP 2139的其中一个版本 , 设计目的是在保持抗病毒活性不变的同时 , 还可以降低在人体肝脏积聚 。 比如在HBV感染临床前模型中 , REP 2165的抗病毒效果和REP 2139相当 , 但在肝脏中累积则明显较少(安全性明显提高) 。
所以 , REP 2165有望在治疗慢性乙肝过程中 , 对减少肝脏积聚的人体具有近似的抗病毒疗效 。 在REP 102研究中 , 有12名e抗原阳性受试者(大三阳)接受REP 2139-Ca治疗32周-58周 。 9名乙肝表面抗原和HBV-DNA水平 , 较基线下降大于2 log10的受试者有资格接受胸腺肽α和或聚乙二醇干扰素-α的附加免疫治疗 。

文章图片
在REP 2139 Ca单药治疗24-40周后 , HBV-DNA和乙肝表面抗原水平降低小于1 log10的受试者 , 归类为无反应情况 , 他们并接受了恩替卡韦治疗 。 当中 , 9名乙肝表面抗原阴转 , 伴有乙肝表面抗体出现(血清转化)中 , 有8名乙肝表面抗原水平下降或消失 , 研究表明HBV感染得到了功能性治愈或称功能性控制 。 研究人员研究了REP 2139 Ca治疗期间乙肝表面抗原准种的动力学 , 发现应答者的表面抗原准种复杂性比无应答者下降 。
在2019年 , 该药在英国伦敦的一次HBV终点会议上提出了一项II期临床试验(REP 401)(NCT02565719) 。 这些实验把REP 2139 Mg或REP 2165 Mg与传统剂量的Peg-IFN-A和TDF相结合 。 随机分为实验组(20~1周)和对照组(20~1周) 。 实验组给予TDF、peg-IFN-a、rep2139mg或rep2165mg(1:1250mg静脉滴注qW)48周 。 对照组接受48周的TDF+peg-IFN-a治疗 , 但都在使用TDF+peg-IFN-α24周后 , 乙肝表面抗原没有下降3-log10 , 所有受试者都已经过渡到48周的核酸聚合物(NAPs)试验治疗 。
在这种三联疗法治疗结束时 , 67%的受试者的乙肝表面抗原滴度小于1 IU/mL 。 在完成24周-48周随访的34名受试者中 , 41%实现了功能性治愈(乙肝表面抗原检测不到) 。 对REP 2139 Mg和REP 2165 Mg的反应无法区分开来 。 值得注意的是 , 超过90%的受试者具有ALT信号 。 在获得功能性治愈的受试者中 , 耀斑更为明显 。 在无症状受试者中 , 闪光时自分辨的 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn110E9B242020.html
标题:受试者|乙肝在研新药REP2165,401研究,41%实现功能性治愈
