按关键词阅读:
与许多其他病毒相比 , 乙肝病毒(HBV)的细胞内转运是相当复杂的 , 因为除感染性病毒颗粒外 , HBV复制细胞还形成、运输并最终释放出亚病毒颗粒 。 不同的HBV特异性颗粒通过不同的途径释放 。 近年来 , 乙肝新药开发靶点之一 , 干扰核衣壳或病毒形态发生和细胞内运作已成为一种潜在抗病毒策略 。
【新药|乙肝在研新药干扰核衣壳,德国科学家研发,HBV颗粒细胞内转运】
文章图片
乙肝在研新药干扰核衣壳 , 德国科学家研发 , HBV颗粒细胞内转运
在介绍这种乙肝新药开发靶点前 , 我们可以先来了解一下 , HBV颗粒的细胞内转运 。 这也是2020年9月2日发表于Cells杂志上 , 由德国柏林病毒学系、德国斯图加特费尔巴哈罗伯特博世有限公司研究人员重点介绍的慢性乙肝药物研发思路 。 德国研究人员介绍 , HBV是一种部分双链DNA基因组的包膜病毒 , 可以导致超过2.4亿例慢性肝炎症(肝炎) 。
深入了解后发现 , 其通过受体介导的内吞作用摄取病毒离子后 , 乙肝病毒核衣壳被转运到核孔复合体 。 在核篮子里 , 核衣壳再解体 。 乙肝病毒基因组与病毒多聚酶共价连接 , 携带二分体NLS , 被导入细胞核 。 在这里 , 部分双链DNA基因组再被转换成一个微小的染色体样结构 , 也就是人们熟知的共价闭合环状DNA(cccDNA) 。
文章图片
乙肝病毒通过一种前基因组RNA(pgRNA)中间产物进行复制 , 这种中间产物被反向转录成DNA 。 HBV感染细胞 , 在感染性病毒颗粒外释放出2种形式的非感染性亚病毒颗粒(球体核细丝) , 它们由表面蛋白组装而不含外壳与核酸 。 此外 , 乙肝病毒复制细胞释放裸衣壳 。 感染性病毒颗粒与细丝 , 通过多体释放;球体由经典的组成性分泌途径分泌 。 科学家目前对裸衣壳的释放还不完全清楚 , 所以 , 我们对自噬过程进行了讨论 。
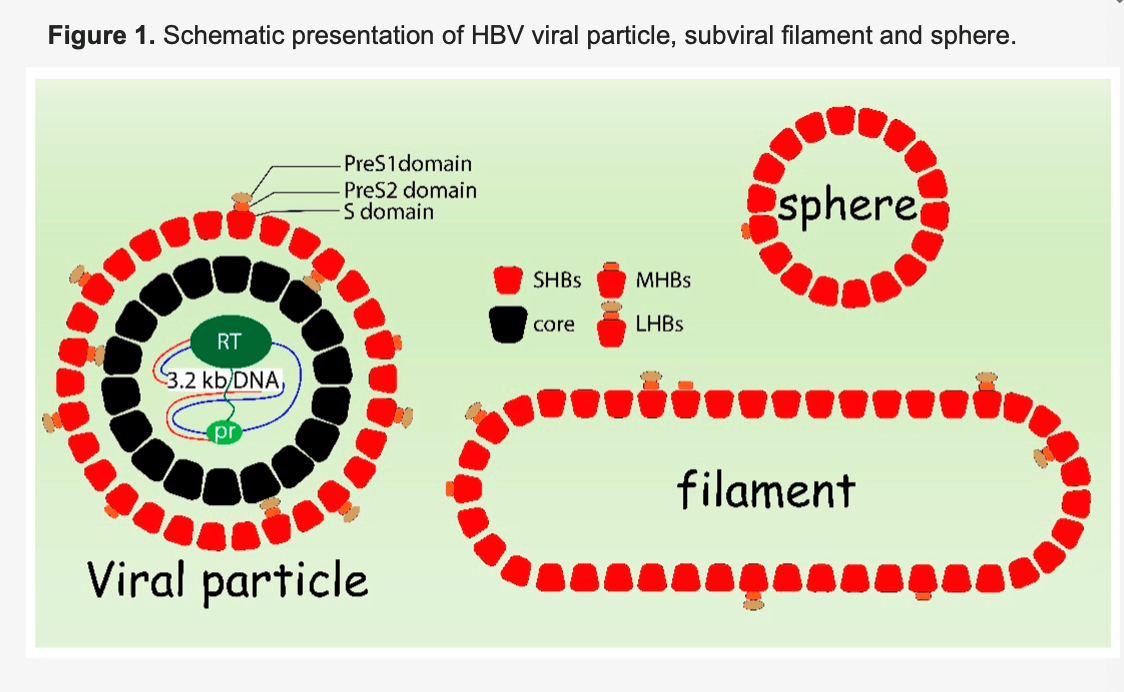
这项科学研究也是德国研究人员详细介绍 , 与病毒进入、形态发生核(亚)病毒颗粒释放有关的细胞内转运途径 , 通过研究结论已证实当前的乙肝全球创新药物靶点之一 , 衣壳抑制剂的科学性 。 HBV家族是一类小型嗜肝DNA病毒 , 也是一种包膜病毒 , 其含有3种病毒表面蛋白分别是LHB(大型HBV表面蛋白)、MHB(HBV表面蛋白)、SHB(小型HBV表面蛋白) , 它们是嵌入细胞膜中的完整膜蛋白 。
文章图片
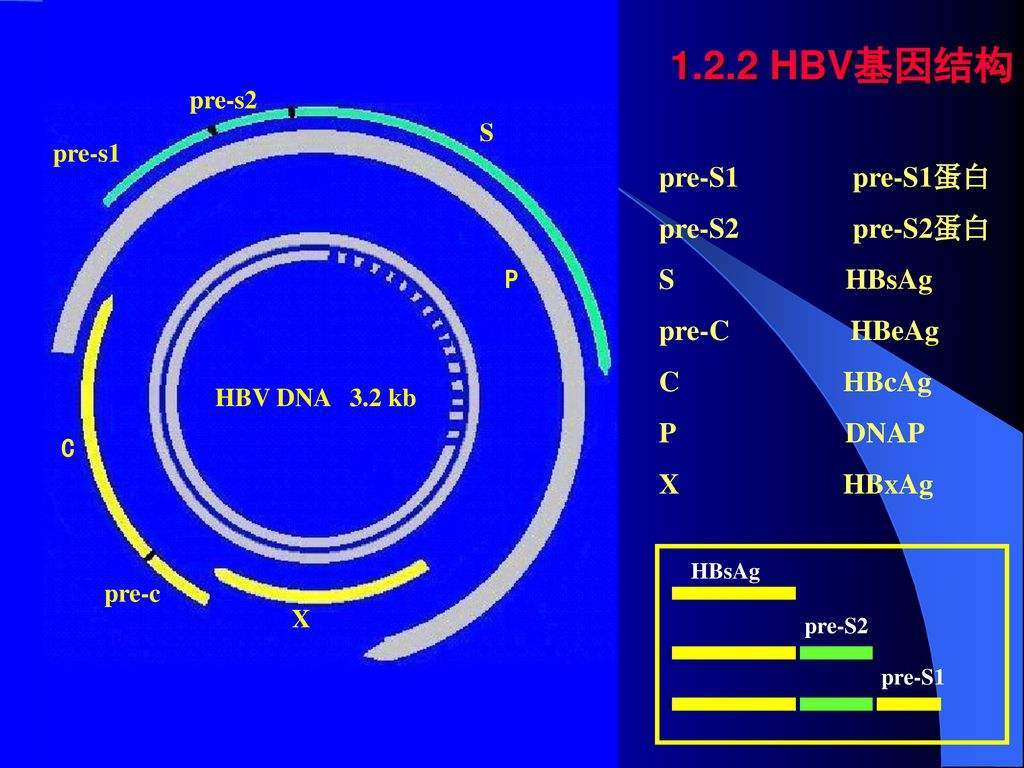
核衣壳周围有一层膜 。 核衣壳由核心蛋白(HBc)组装而成 , 携带病毒DNA基因组 。 病毒基因组为部分双链DNA , 大小约为3.2kb 。 除作为感染性病毒颗粒的一部分 , 表面蛋白还可以形成缺乏衣壳与基因组的非传染性亚病毒颗粒(SVP) 。 SVP以直径为22nm的球体核长度在80到400nm之间的长丝形式存在(见上图:来自本研究德国科学家 乙肝病毒颗粒、亚病毒丝核球体示意图) 。
HBV包膜蛋白 , 又称为乙肝表面抗原 , 是由一个单独的开放阅读框编码 , 该阅读框被PreS1、PreS2和S区的3个框内起始密码子分割 。 这3种表面蛋白与226个氨基酸共享S结构域 , 形成SHBs 。 SHBs是通过ER膜上不同的跨膜区插入的 。 第一个内质网跨膜区(TM1)包括aa8-22 , 随后是胞浆环aa23-79 。 第二个跨膜结构域(TM2)(aa 80–98)指示aa 99–169的管腔暴露 , 其中包含HBsAg的主要构象表位(a决定簇aa 124–147)和N-糖基化位点 。
文章图片
与SHBs相比 , MHBs在S域的拓扑结构上没有差异 。 MHBs的PreS2结构域直接位于内质网腔 , 在Asn-4处被N-糖基化 。 LHBs的N端发生肉豆蔻酰化反应 。 肉豆蔻酰化位点的完整性对HBV的传染性至关重要 。 前1pres2结构域和S域的前7aa面向ER的内腔[位于内质网腔(e-PreS)的PreS结构域暴露在病毒表面 , 介导病毒与细胞的相互作用 , 而面向胞浆的结构域(i-PreS)被假定在病毒包被过程中与核衣壳相互作用 。 此外 , 面向细胞质的PreS2结构域作为一种调节蛋白 , 结合并激活经典的PKC亚型 , 从而激活c-Raf依赖的信号级联 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn1031b96302020.html
标题:新药|乙肝在研新药干扰核衣壳,德国科学家研发,HBV颗粒细胞内转运
