按关键词阅读:
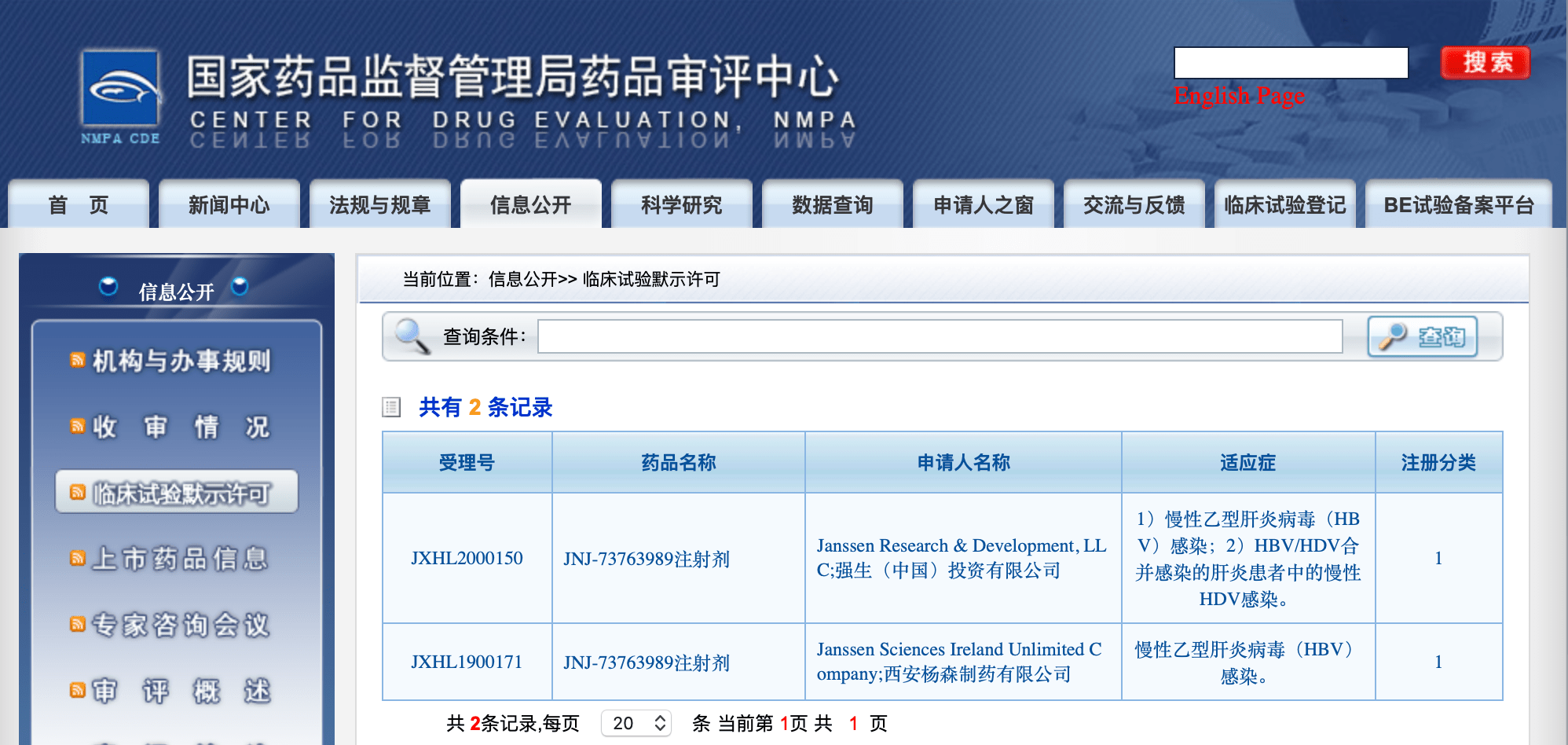
乙肝在研新药JNJ-73763989(其他名称:JNJ-3989) , 它是一种肝脏靶向性皮下注射抗病毒药物(注射剂) , 通过核糖核酸干扰机制治疗慢性乙肝病毒(HBV)感染 。 该药目前正在国内外进行人体临床试验阶段 , 通过国家药监局药品审评中心查询 , 均可观察到其已获得临床试验默示许可 。
文章图片
乙肝/丁肝在研新药JNJ-3989 , 九月启动II期 , 注射剂型
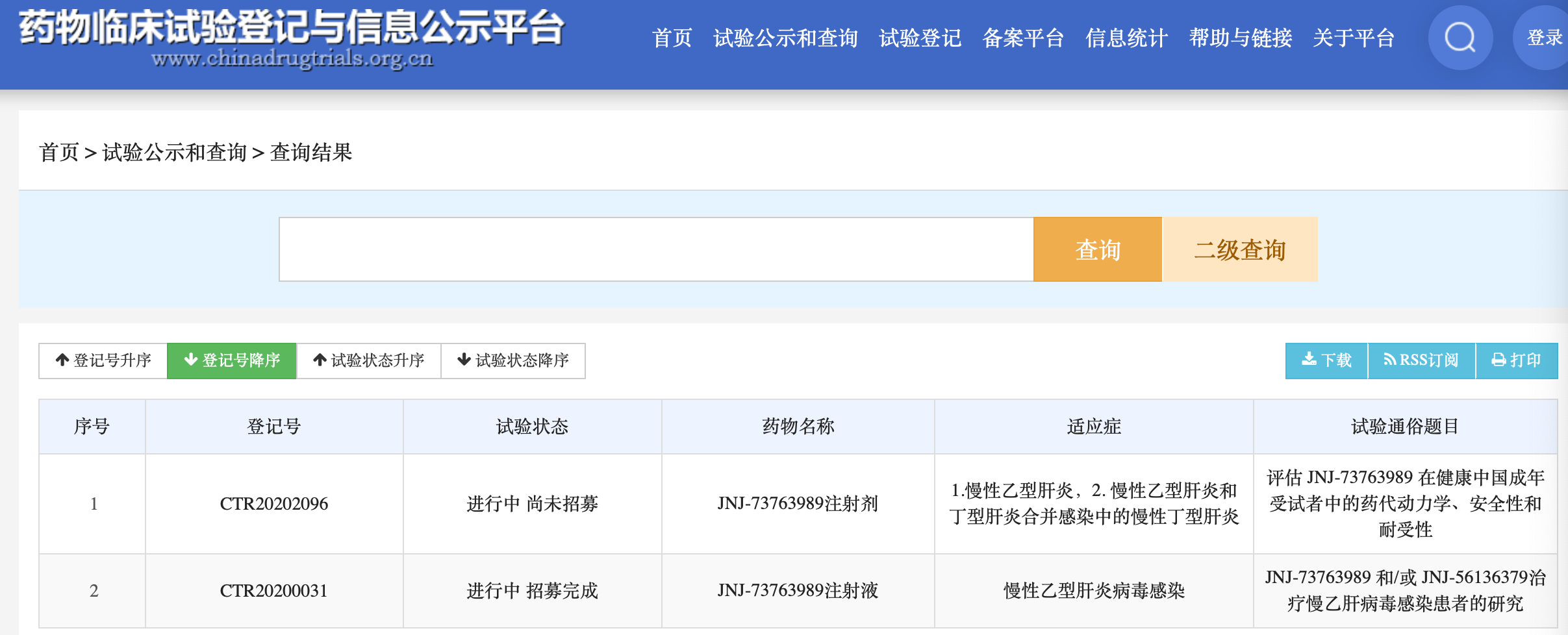
JNJ-73763989是由强生旗下的杨森公司(Janssen Research & Development, LLC)研发的 , 2020年10月1日 , 该公司登记一项最近临床试验进度 , 评价JNJ-73763989+核苷酸类似物(NA)方案在乙肝病毒(HBV)感染和丁肝病毒(HDV)感染的治疗效果(NCT04535544) 。 这是一项第2期临床试验 , 研究主要内容是 , 评估JNJ-73763989对乙肝病毒合并丁肝病毒感染者治疗的安全性和有效性 。
【九月|乙肝/丁肝在研新药JNJ-3989,九月启动II期,注射剂型】这项研究又分为2个部分组成:第1部分评估JNJ-73763989+NA的安全性、耐受性和抗病毒活性;第2部分评估JNJ-73763989+NA治疗HBV/HDV合并感染的安全性和有效性 。 每个部分包括3个阶段:筛查阶段(4周至最多8周)、干预阶段(A组144周 , B组148周)和随访阶段(48周) 。 个人参与研究的持续时间为196至204周 。 安全性和耐受性(包括不良事件和严重不良事件、实验室评估、心电图、生命体征、体检)疗效(包括HDVRNA、HBVDNA和抗原) , 以及药代动力学 。

文章图片
这项第2期临床研究共纳入190名受试者 , 使用随机、平行作用 , 掩蔽:双重(参与者、研究者) , 一项II期多中心、随机、双盲、安慰剂对照研究 , 研究对象为JNJ-73763989+核苷类药物对合并感染乙肝和丙肝的受试者 。 这项第2期HBV/HDV合并感染研究 , 已于2020年9月17日开始 , 预计这项第2期将于2023年6月7日完成 , 预计第2期全部完成日期:2026年6月30日 。
本研究试验设计方法如下:手臂干预/治疗 , 实验组:JNJ-73763989+NA , 在第1部分和第2部分中 , 受试者将每4周(Q4W)接受一次皮下注射JNJ-73763989以及NA(恩替卡韦ETV、富马酸替诺福韦二吡呋酯TDF、富马酸替诺福韦艾拉酚胺TAF) , 每日一次 , 共144周 。 安慰剂对照组:延迟有效治疗组:安慰剂+NA+JNJ-73763989+NA , 在第1部分和第2部分中 , 受试者接受与JNJ-73763989 SC注射剂Q4W和NA(ETV、TDF及TAF)相匹配的安慰剂 , 每日一次 , 持续52周 , 随后是JNJ-73763989 SC注射液Q4W和NA , 共96周 。
文章图片
杨森公司研究人员将观察本研究如下主要结果指标:在第48周时 , HDVRNA>=2 log10 IU/mL下降或HDV-RNA TND与ALT正常相结合的受试者百分比 。 次要结果指标包括:在第48周时 , HDVRNA≥2 log10 IU/mL的受试者百分比较基线或HDV RNA TND下降;在第48周时 , 通过VCTE(FibroScan)评估的LSM较基线下降>=2 kPa的参与者百分比将报告第48周通过振动控制瞬态弹性成像(VCTE);
第48周的乙肝表面抗原血清清除率的受试者百分比;到204周时 , 将报告HDVRNA≥2 log10 IU/mL的受试者百分比 , 或HDV RNA TND与正常ALT联合下降 , HDV RNA≥2 log10 IU/mL的受试者与正常ALT联合下降的百分比 , HDV-RNA-TND合并ALT正常的受试者百分比以及HDV RNA≥2 log10 IU/mL的受试者百分比较基线或HDV RNA TND下降 。

稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn102OSA42020.html
标题:九月|乙肝/丁肝在研新药JNJ-3989,九月启动II期,注射剂型
