按关键词阅读:
DCR-HBVS , 正在开发用于治疗成人慢性乙肝(CHB)(国外开展人体临床试验 , 国内尚未提交) 。 DCR-HBVS的I期临床试验将评估在慢性乙肝患者的安全性和疗效 , 试验题目:DCR HBVS安全性和耐受性研究(临床试验编号:NCT03772249) 。

文章图片
乙肝在研新药DCR-HBVS , I期3个部分进行 , 皮下注射剂型
DCR-HBVS是生物制药公司Dicerna Pharmaceuticals, Inc.和罗氏制药共同研发的乙肝在研新药之一 , 上次更新发布时间:2020年8月31日 。 I期分3个部分进行 , 正常健康志愿者(a组)为单次递增剂量(SAD)阶段 , 慢性乙肝患者为单剂量(SD)阶段(B组) , CHB患者为多剂量(MAD)阶段(1c-3c组) 。 队列4c是单次递增剂量 , 持续时间可能长达48周 。 队列5c是一个多剂量队列 , 可能持续72周 。
I期预计纳入70名受试者 , 是一项随机、序贯分配干预模型描述是从单次递增剂量(SAD)阶段进展到多剂量(MAD)阶段的第一个队列 , 取决于安全审查委员会(SRC)对至少前2个SAD队列中 , 所有NHV的剂量后安全性和耐受性数据进行至少14天的审查 。 SRC将从SAD阶段选择一个(或多个)耐受良好的剂量 , 用于SD和MAD阶段的给药 。
文章图片
3毫克/千克剂量的B组和3毫克/千克剂量水平的C组平行开始 。 在所有研究阶段 , 给药时间应与前哨受试者的使用时间错开 , 以便在其他受试者接触研究药物之前 , 有时间评估安全性 。 第4c组和第5c组的固定给药方案 , 是在SRC回顾和评估第3c组的所有数据后确定的 。 4c和5c组不会出现前哨给药 。 本研究可以在美国临床试验数据库或生物制药公司Dicerna Pharmaceuticals, Inc.查询到科研进展 , I期实际研究开始日期:2018年12月28日 , 预计初步完成日期:2022年7月 。
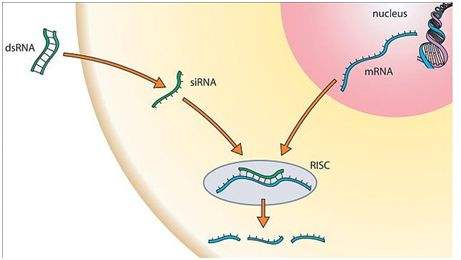
乙肝在研新药DCR-HBVS采用皮下注射剂型 , 是一种合成核糖核酸干扰(RNAi)药物 , 它由一个双链寡核苷酸与N-乙酰-D-半乳糖胺(GalNAc)配体结合而成 。 DCR-HBVS是注射用水(WFI)中浓度为195千克/毫升的siRNA(DCR-S219)的无菌溶液(其他名称:DCR-S219) 。 I期临床药物对照品将是无菌注射用9%生理盐水(本研究具体试验设计已略) 。

文章图片
研究人员将关注本研究结果主要指标包括:治疗4周时 , 根据CTCAE v5.0评估的有不良事件的健康志愿者人数;治疗第16周时 , 根据CTCAE v5.0评估有不良事件的非肝硬化慢性乙肝患者人数 。 次要结果指标包括:治疗4周时 , 通过监测DCR-S219的血浆药代动力学曲线 , 来表征DCR-HBVS在健康志愿者体内的药代动力学特征;治疗12周时 , 测量DCR-HBVS肾清除率的量;
【新药|乙肝在研新药DCR-HBVS,I期3个部分进行,皮下注射剂型】按照新药研发流程 , 通常在进入人体I期临床研究阶段 , 都会先在健康人中进行 , 本研究为RNAi干扰类药物DCR-HBVS的I期临床研究 , 成人需符合18-65岁 , 接受健康志愿者 , 能够给予知情同意 , 12导联心电图在正常范围内或无临床显著异常 。 酒精或滥用药物的阴性筛查 。 不吸烟至少3个月 , 筛查时尿可替宁浓度为阴性 。 BMI在18.0-32.0 kg/m2(含)范围内等 。
文章图片
排除在本I期研究标准:任何可能影响研究药物吸收、分配或消除的病史;高血压控制不良或不稳定;使用胰岛素或降糖药治疗的糖尿病病史;过去12个月内有哮喘病史需要住院治疗;G-6-PD缺乏症的证据;目前控制不好的内分泌疾病 , 不包括甲状腺疾病;多药过敏史或对寡核苷酸或GalNAc过敏反应史;给药前3个月内 , 服用了研究药物或正在进行另一项研究的随访;抗病毒药物(除恩替卡韦或替诺福韦外)在过去3年内筛查或干扰素治疗后3个月内(仅B组和C组);免疫调节剂组 。 
稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn10149B2502020.html
标题:新药|乙肝在研新药DCR-HBVS,I期3个部分进行,皮下注射剂型
