按关键词阅读:
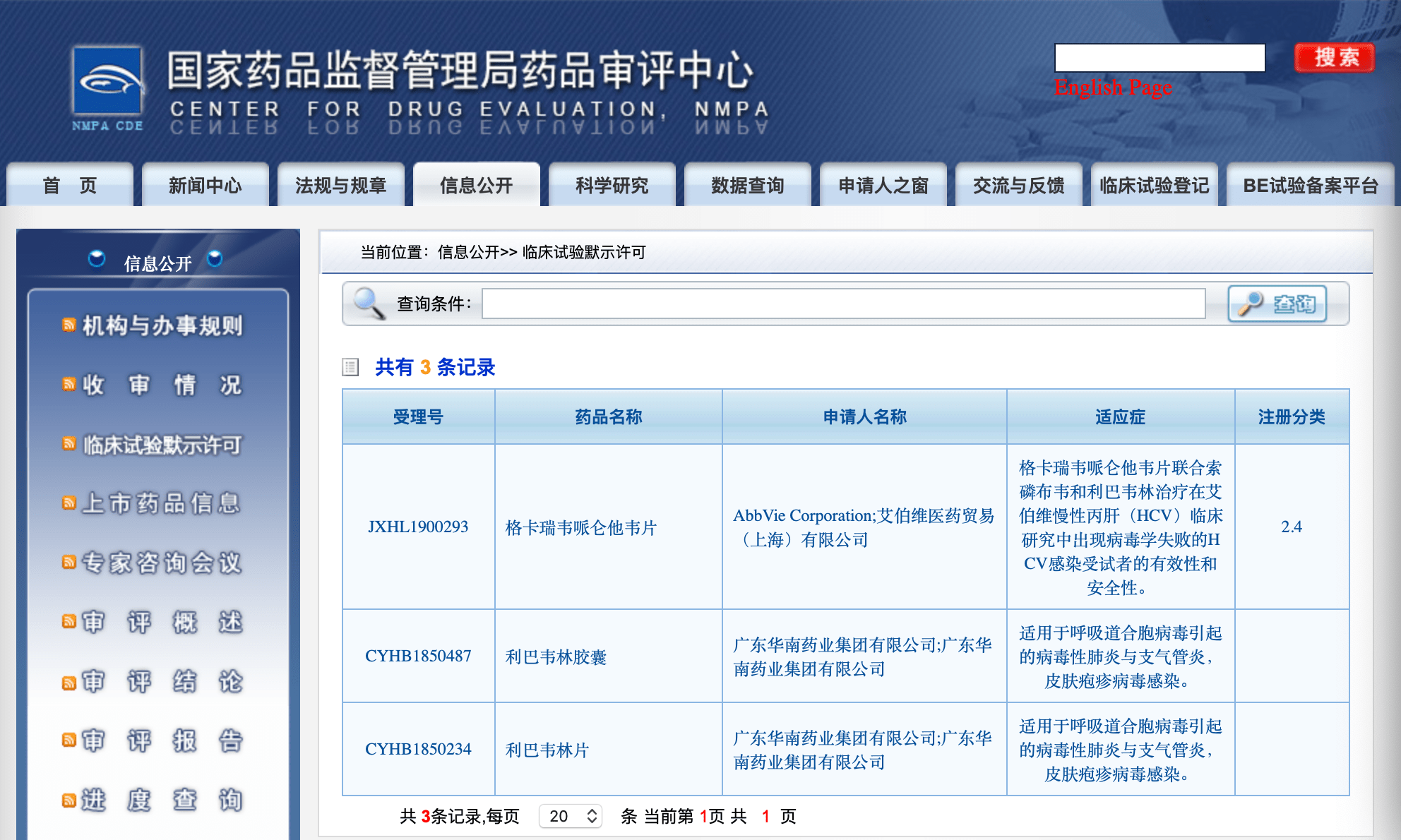
由渥太华医院研究所(Ottawa Hospital Research Institute)主导的一项III期临床科学研究 , 主要观察以往用于治疗丙肝病毒(HCV)的利巴韦林(Ribavirin)增强核苷酸类似物抗乙肝病毒活性作用(临床试验编号:NCT03759782) , 本研究于2020年9月15日最新发布(我国已获批临床试验默示许可利巴韦林适应症见下图) 。
文章图片
乙肝潜在新药利巴韦林 , III期渥太华研究所主导 , 联用替诺福韦
乙肝病毒和丙肝病毒均会导致并危及生命 , 比如慢性乙肝和慢性丙肝最直接的转归方向如肝衰竭和肝癌(HCC) 。 渥太华医院研究所研究人员指出 , 目前对大多数人而言 , 彻底治愈乙肝是不可能的 。 因为目前的乙肝抗病毒治疗药物(使用核苷酸类似物)不能清除他们肝脏里面的乙肝病毒 。 虽然 , 乙肝病毒治疗药物通常是单独使用(单药治疗) , 但本研究将探讨 , 利用利巴韦林与标准疗法结合使用 。
这种结合方案 , 主要目的是加强目前核苷酸类似物的抗病毒作用 。 利巴韦林通常是用于治疗丙肝病毒(HCV) , 但有证据表明 , 利巴韦林还可以诱导免疫反应 , 对乙肝病毒治疗有益 。 本研究的目的是 , 确定利巴韦林和核苷酸类似物联合治疗是否比单独使用核苷酸类似物更有效 。 根据标准的临床和病毒学检测 , 以及对乙肝病毒的免疫应答 , 对登记的受试者进行随访 。
文章图片
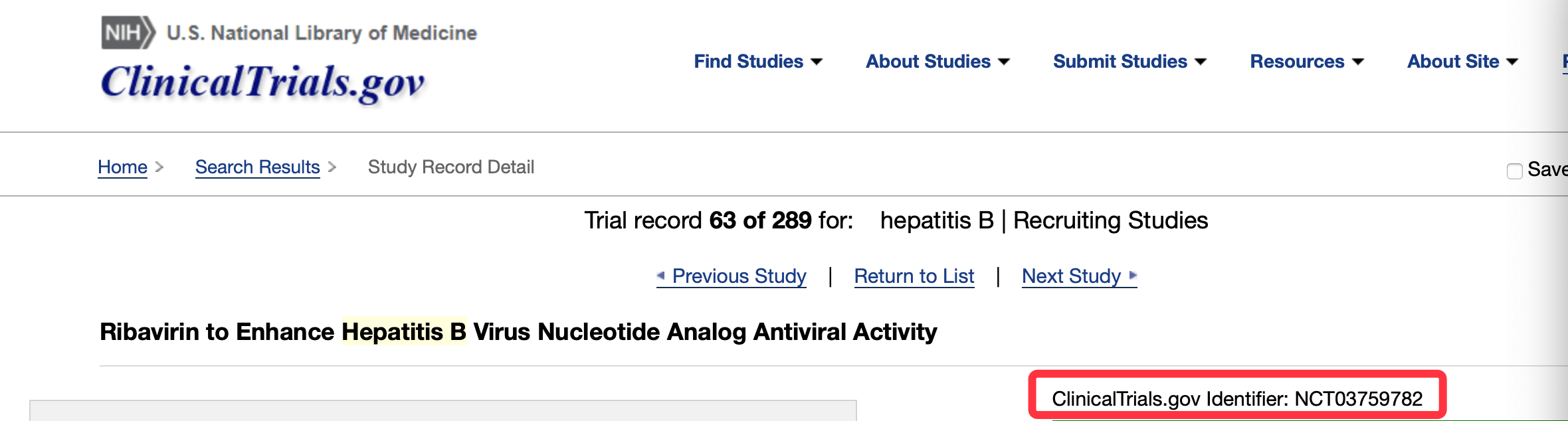
【利巴|乙肝潜在新药利巴韦林,III期渥太华研究所主导,联用替诺福韦】渥太华医院研究所研究人员介绍了本研究最终目标是 , 为乙肝病毒携带者找到一种更有效的治疗方法和改善健康状况 。 研究使用的核苷酸类似物是富马酸替诺福韦二吡呋酯(TDF) , 这也是利巴韦林的III期临床 , 共纳入24名受试者 , 属于随机、平行、开放标签使用利巴韦林的免疫调节特性来增强乙肝核苷酸类似物抗病毒活性 , 研究开始时间:2019年1月10日 , 预计初步完成时间:2021年1月1日 , 预计整体完成时间:2021年3月1日 。
利巴韦林III期治疗慢性乙肝试验设计如下:手臂干预/治疗 , 实验组1 , 300毫克剂量组的富马酸替诺福韦二吡呋酯(TDF) , 每日给药1次 。 主动比较器:第2组 , 每日1次服用300毫克富马酸替诺福韦二吡呋酯(TDF)+400毫克利巴韦林 , 每日2次(BID);如果每日早晨(AM)小于70千克/600毫克 , 那么每日晚上(PM)服用400毫克;如果每日早晨(AM)大于或等于70千克/600毫克 , 那么利巴韦林将加入标准护理治疗(使用TDF)方案24周 。

文章图片
渥太华医院研究所将关注本试验(III期)以下主要结果指标包括:在连续24周治疗期间 , 以上2个实验组的受试者血清HBV-DNA值下降 , 主要指HBV-DNA的绝对下降和乙肝表面抗原滴度的绝对下降 , 将与每次研究随访时的基线水平进行比较(有货没有RBV) 。 次要结果指标包括:治疗24周时 , 纤维扫描评分 , 即各组在治疗前和治疗后的单独纤维扫描评分 , 使用以千帕计算的纤维化分数F0表示无纤维化 , F4值表示肝硬化;
治疗24周时 , 肝酶值 , 指受试者每次就诊时肝脏酶的个体降低;治疗28周时 , CTCAE v4.0评估的与治疗相关的不良事件的参与者人数 , 主要是评估富马酸替诺福韦二吡呋酯(TDF)+利巴韦林(Ribavirin)方案的安全性 。 本研究不接受健康志愿者 , 年龄要符合18岁以上成人或老年人 , 乙肝表面抗原阳性至少24周;HBV-DNA水平大于2000 IU/mL 。


稿源:(小番健康)
【】网址:http://www.shadafang.com/c/hn10129634542020.html
标题:利巴|乙肝潜在新药利巴韦林,III期渥太华研究所主导,联用替诺福韦
