按关键词阅读:
7月9日 , 国家药监局综合司发布了一则《关于进一步加强 医疗器械强制性行业标准管理有关事项》的通知(后简称《通知》) , 要求有关单位加强对行业标准的认识 , 切实推进医疗器械强制性行业标准规范 , 并有效实施 。 其中 ,PGT-A试剂盒也将在8月1日 , 作为Ⅲ类医疗器械首次纳入国家强制性医疗器械行业标准中 。
文章图片
医疗器械强制性行业标准是在医疗器械产品无强制性国家标准时 , 应当遵循的金标准 。 根据2014年国务院公布的《医疗器械监督管理条例》总则第六条规定:医疗器械产品应当符合医疗器械强制性国家标准; 尚无强制性国家标准的 , 应当符合医疗器械强制性行业标准 。 充分肯定了 医疗器械强制性行业标准的法律地位 , 并要求各有关单位切实维护强制性行业标准的权威性 。
《通知》指出 , 医疗器械强制性行业标准是在 医疗器械研制、生产、经营、使用及其监督管理活动中遵循的统一技术要求 , 是为保障人体健康和生命安全 , 涉及产品安全和基本性能要求的标准 。 医疗器械研制、生产、经营、使用单位应当积极参加培训并主动开展内部培训 , 提高标准理解力 , 确保标准实施到位 。
PGT-A试剂盒纳入国家强制性医药行业标准
近年来 , 国家药监局不断推出新的政策文件来规范医疗器械行业的发展 , 从2009年发布首个75项医疗器械行业标准的公告至今 , 已经陆续发布了41条规范医疗器械行业标准的公告 , 覆盖了1100余种医疗器械的行业标准 。
在这其中 , 国家药监局在2019年发布的第60号公告显示:“胚胎植入前 染色体非整倍体检测试剂盒(测序法)”即Preimplantation Genetic Testing for Aneuploidies (PGT-A)试剂盒首次纳入了国家强制性医疗器械行业标准中 , 于2020年8月1日起实施 。 而在这之前 , PGT-A试剂盒一直处于无标准、无监管的空白地带 。

文章图片
节选自国家药监局2019年第60号文件
伴随此次PGT-A试剂盒被纳入国家强制性医药行业标准 , 意味着国家药监局对三代试管婴儿市场的进一步关注和重视 。 可以预见 , NMPA将会加强对三代试管相关检测试剂盒的严格监管 , 从而促进产业向合规化方向发展 , 加速辅助生殖行业的洗牌 。
PGT-A试剂盒属于Ⅲ类医疗器械 , 按照国家医疗器械相关法律强制性规定 ,任何医疗机构(包括医院、医学检验所、医学检验中心等)在开展临床应用项目时 , 均应当使用有注册证的医疗器械 , 产品开发依托的平台也必须获得Ⅲ类医疗器械注册证 。
Ⅲ类医疗器械是我国最高风险级别的医疗器械 , 需要采取特别措施严格控制管理以保证其安全、有效性 。 Ⅲ类医疗器械多指一些对人体具有潜在危险 , 需要植入人体 , 用于支持和维持生命的一类医疗器械 。
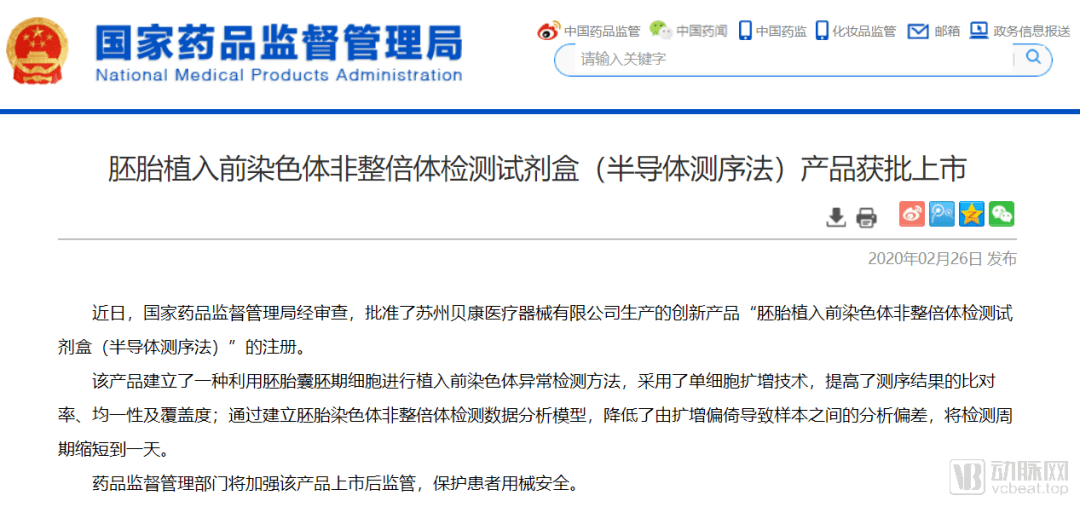
国内首个三代试管PGT-A试剂盒获批上市
文章图片
值得一提的是 , 这是 国内首款获得国家药监局批件的PGT-A检测产品 , 也是目前唯一一个得到官方认可的三代试管产品 。 该试剂盒的上市不仅填补了我国三代试管应用的技术空白 , 标志着三代试管PGT -A检测正式进入有证时代 , 也弥补了国内无合法三代试管产品的窘境 。

文章图片
根据贝康医疗公布的临床数据显示 , 该款PGT-A产品能够将试管婴儿平均妊娠率提升至72% , 平均流产率降低至6.9% 。 
稿源:(动脉网)
【】网址:http://www.shadafang.com/c/hn0H0N34342020.html
标题:检测|PGT-A试剂盒作为Ⅲ类医疗器械首次纳入国家强制性医药行业标准
