国内高校大爆发!今日清华/北大/厦大Nature齐发
第一篇 , 清华大学Nature:用于大脑启发式计算的系统层次结构 文章插图
文章插图
▲第一作者:张悠慧通讯作者: 施路平 张悠慧
第一单位:清华大学计算机系
DOI: 10.1038/s41586-020-2782-y
背景介绍神经形态计算从大脑中汲取灵感 , 提供计算技术和架构 , 有潜力驱动下一代计算机工程 , 为通用人工智能的发展提供了一个很有前途的平台 。 通用人工智能是具备与人类同等智慧或超越人类的人工智能 。 然而 , 与传统计算系统不同的是 , 传统计算系统有一个围绕图灵完备性和冯·诺伊曼结构建立的良好的计算机层次结构 , 目前还没有广义的系统层次结构或对大脑启发计算的完备性的理解 , 使得当前的人工智能成果大都是“狭隘”的 , 即面向特定任务 , 只能解决特定问题 。
本文亮点作者提出“神经形态完备性”(neuromorphic completeness)这一全新概念, 它放松了对硬件完整性的要求 , 降低了软硬件之间的耦合性 , 并通过引入一个新的维度——近似粒度(the approximation granularity)来扩大设计空间 。 并且提出一种系统层次结构 , 由具有图灵完备的软件抽象模型和通用的抽象神经形态结构组成 。 使用这种层次结构 , 可以将各种程序描述为统一的表示形式 , 确保了编程语言的可移植性 , 同时保证硬件完整性和编译可行性 。 这项研究让大脑启发式计算系统的各个方面实现高效且兼容的进步 , 从而促进各种应用程序的开发 。
图文解析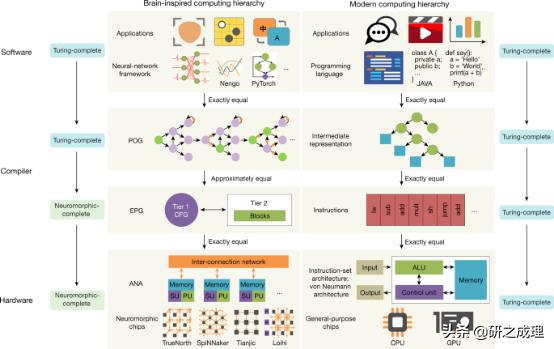 文章插图
文章插图
▲图1: 大脑启发计算系统和传统计算系统的层次结构 。
要点:
1. 对于任意给定的误差间隙ε≥0和任意图灵可计算的函数f(x) , 如果系统能实现一个函数f1(x) , 使‖f(x)?f1(x)‖≤ε满足任何有效输入x , 则称它为神经形态完备的计算系统 。
2. 神经形态完备性将普遍逼近与普遍可计算性联系起来 , 通过近似实现一个函数不需要系统模拟图灵机 。
3. 提出POG(programming operator graph)作为软件的中间表示;设计抽象神经形态体系结构ANA(abstract neuromorphic architecture)作为硬件抽象 , 包括一个 EPG (execution primitive graph) , 作为硬件的中间表示为上层的接口来描述它可以执行的程序;引入了编译工具以将POG转换为EPG 。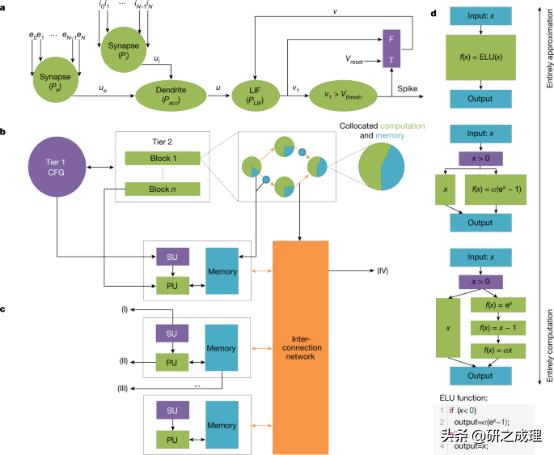 文章插图
文章插图
▲图2:POG, EPG , ANA. 要点:
1. POG是图灵完备的 , 并且集成了存储和处理 。 (图2a)
2.ANA( EPG )接口具有控制-流-数据流的混合表示 , 加强了它对不同硬件的兼容性 , 且符合当前混合架构硬件的发展趋势 。 (图2c)3. EPG同时具有神经形态完备性和图灵完备性两种极端 , 用不同的近似粒度以不同的形式表示(在性能和资源消耗之间有不同的权衡) 。 (图2d)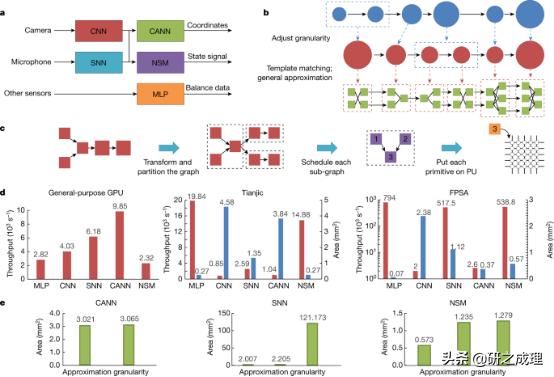 文章插图
文章插图
▲图3: 工具链和自行车驾驶跟踪实验 。 要点:
1. 通用GPU完全依赖于精确计算 。 FPSA主要通过近似来实现不同的功能 。 Tianjic支持精确计算和近似 。 证明近似粒度的选择对硬件成本有很大影响 。 (图3 d e)
2.用三个应用程序证明该层次结构的可行性和多功能性 。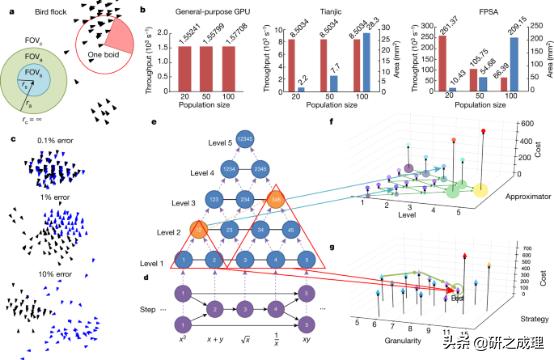 文章插图
文章插图
▲图4: 实验结果 。 要点:
1. 鸟群系统仿真实验证明该方法的应用范围可以扩展到非神经网络 。 (图4 c,b)
2. 因式分解实验证明只要满足一定的误差限制 , 在近似粒度与神经形态完备性所引入的性能之间的权衡有利于降低硬件成本 。 (图4 e,f,g)原文链接:
第二篇:北京大学Nature:NAD+介导的神经退行性蛋白自我抑制机制 文章插图
文章插图
▲第一作者:Yuefeng Jiang通讯作者:Jing Yang ,Zhe Zhang
通讯单位:北京大学 , 生命科学学院
DOI: 10.1038/s41586-020-2862-z
背景介绍轴突的病理变性破坏了神经回路 , 是神经退行性变的特征之一 。 Sarm1是神经退行性过程的中央调节因子 , 其TIR域通过NAD酶活性发挥神经退行性作用 。 然而 , Sarm1激活的严格控制背后的机制仍有待完全理解 。
本文亮点1. 本文报告了全长Sarm1蛋白质在2.6-3.0埃分辨率下的冷冻电镜结构 。 2. 作者发现NAD+是ARM结构域的意外配体 。 这种NAD+结合促进了ARM结构域通过其结构域接口抑制TIR结构域的NAD酶 。 3. NAD+结合位点的破坏或ARM-TIR相互作用引起组成性活性的Sarm1会导致轴突变性 。 4. 这些发现揭示了这种新的NAD+介导的中枢神经退行性变蛋白的自我抑制 。
- 对手|一加9Pro全面曝光,或是小米11最大对手
- 同比|亚马逊公布“剁手节”创纪录战绩:第三方卖家全球销售额超48亿美元 同比大增60%
- 人民币|天猫国际新增“服务大类”,知舟集团提醒入驻这些类目的要注意
- 痛点|首个OTA智能社区诞生 解决行业四大痛点
- 王兴称美团优选目前重点是建设核心能力;苏宁旗下云网万店融资60亿元;阿里小米拟增资居然之家|8点1氪 | 美团
- 零部件|马瑞利发力电动产品,全球第七大零部件供应商在转型
- 长安|长安傍上华为这个大腿,市值暴涨500亿!可见华为影响力之大?
- 通气会|12月4~6日,2020中国信息通信大会将在成都举行
- 程序|2020全景生态流量秋季大报告:TOP100APP超半数布局小程序,全景流量重塑行业竞争新格局
- 操盘|中兴统一操盘中兴、努比亚、红魔三大品牌
