历史回顾
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤(NHL),具有较强的生物学异质性。在历史上,局限期DLBCL定义为Ann Arbor I期或II期疾病,且病变部位包含在单个放射野中。目前根据Lugano标准定义,局限期或早期疾病定义为I期或II期,而晚期疾病则定义为III期或IV期。大包块病变是经典分期的重要修饰因素,现进一步讨论如下。大型描述性研究报告中,局限期疾病患者的中位年龄在60岁,男性略占优势,最常见的解剖部位是颈部淋巴结和/或头颈部区域,包括韦氏环。然而,关于局限期和晚期之间的定义仍存在争议,一方面它是否可以真实反映疾病的早期识别,另一方面是否可以反映具有不同风险和预后特征的生物学独特实体。
首先从SWOG 8736研究说起,它影响了局限期DLBCL的现代治疗策略。这项在利妥昔单抗治疗前时代(1988-1995年)进行的3期研究,确立了联合治疗模式作为利妥昔单抗治疗前时代的标准治疗,它证实环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)联合放疗(RT)3个周期不劣于单纯CHOP 8个周期,为局限期患者定义了新的标准治疗周期并纳入放疗,也一直是后续局限期DLBCL临床试验的基石。
抗CD20单抗利妥昔单抗进一步改善了局限期DLBCL的生存期,美罗华的MInT研究发现,接受R-CHOP治疗的非大包块、局限期DLBCL的6年无事件生存率(EFS)(84.3%)和6年OS(94.9%)均优于CHOP,且在长期随访中,这些生存获益未显著增加毒性或继发性血液恶性肿瘤的发生率,从而确定了化学免疫治疗在预后良好的年轻局限期DLBCL患者中的优效性。
到了现代,局限期DLBCL患者的治疗进一步发展,需要重新考虑RT的作用、全身治疗的最佳时长以及PET代谢影像学在反应适应性(response-adapted)治疗中的新作用。
《Blood Cancer Journal》近日发表了一篇综述,芝加哥大学的Alexandra E. Rojek和Sonali M. Smith共同撰文,重点关注局限期DLBCL的治疗和相关研究(表1)、该疾病的挑战和未来考虑,以及作者推荐的治疗策略。
文章插图
局限期DLBCL的生物学是否与晚期不同?
DLBCL是一种高度异质性的肿瘤,在形态学、基因表达和生物学调控方面均存在较大差异。局限期DLBCL与晚期的生物学尚不清楚,仍有待确定到底是早期疾病表现还是真正的生物学差异。在晚期疾病中,已知的预后指标包括细胞起源(COO)和MYC和BCL2重排或蛋白过表达,COO可能影响治疗选择,GCB亚型的预后优于非GCB,而MYC和BCL2和/或BCL6失调导致的“双打击/三重打击的高级别B细胞淋巴瘤(HGBLDHL/THL)”也与较差的生存结局相关,此外相关蛋白的过表达也是晚期疾病的不良预后指标,通常称为双表达淋巴瘤(DEL)。
尽管关于局限期DLBCL中COO的数据少,但约60-75%认为是起源于GCB。COO在局限期疾病中的预后意义可能与晚期疾病相对应,在一项研究中,尽管GCB和非GCB亚型中局限期疾病的比例相似,但非GCB患者表现更差,5年PFS和OS分别仅有48%和 56%,而GCB患者为73%和78%(尽管这一结果跨越了DLBCL所有分期)。S1001研究中GCB患者的PFS也优于非GCB亚型。
【 局限期|局限期弥漫大B细胞淋巴瘤的治疗演变】 DHL或DEL患者中局限期疾病的患病率各不相同,且迄今为止也未彻底研究。在一项研究中,首次完全缓解的DHL患者中24%为局限期疾病,而另一项局限期疾病研究仅有19%的DEL和4%的DHL患者。DHL或DEL对局限期疾病预后的影响,亚组分析发现DHL/DEL人群的结局无差异。
DLBCL的另一个组织病理学变化是既往或并发惰性淋巴瘤。在最近一项所有DLBCL分期的前瞻性队列研究中,三分之一的局限期患者并发滤泡性淋巴瘤,这些并发惰性淋巴瘤患者通常为GCB亚型,且各分期的结局与新发GCB亚型DLBCL相当。许多临床试验排除了惰性淋巴瘤转化患者或既往接受过治疗的患者,因此,惰性淋巴瘤转化至局限期DLBCL的真实发生率和临床意义仍未知。
因此,局限期DLBCL是否是生物学上不同的实体这一问题完全仍没有得到解答。
初步治疗:联合治疗还是单独化疗?
与晚期DLBCL相似,局限期DLBCL的最佳治疗方案包括利妥昔单抗联合化疗方案,且随后在初始分期和缓解评估中纳入PET。这两个具有里程碑意义的变化影响了当代的试验设计和标准治疗,因为将RT纳入局限期DLBCL的治疗仍存在争议。单纯放疗作为一线治疗并不够,因为放射野外复发率高,因此放疗(使用时)通常是联合模式方法的一部分。下面是解决RT在现代治疗时代价值的一些重要研究。
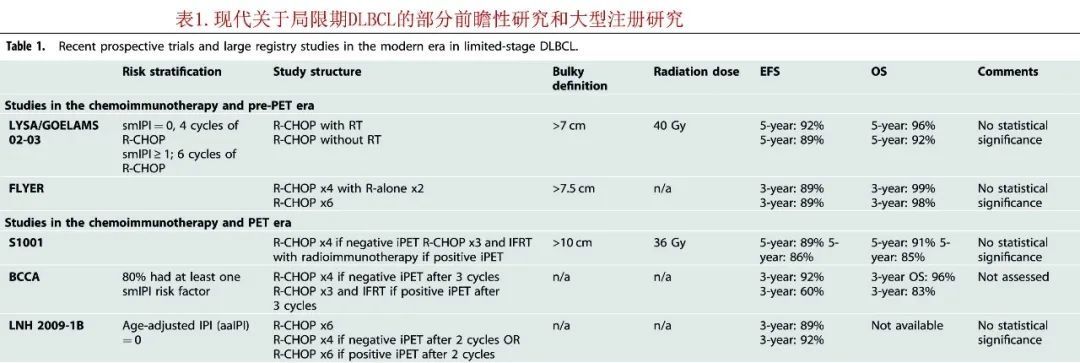
前化学免疫疗法和前PET时代的研究
在利妥昔单抗治疗前时代,许多研究评估了联合治疗与单独化疗,但结果相互矛盾。SWOG 8736研究最初确定3周期CHOP加RT可改善5年结局,但本研究的现代应用受到对照组的限制,因为对照组纳入的化疗周期多于目前的标准。此外随着随访时间延长至接近18年,这些组的PFS或OS无统计学显著差异,两组的持续复发均明显。
20世纪90年代早期的两项GELA研究表明,单独化疗的结局极佳。在GELA-93-1研究中,局限期且无不良IPI预后因素的患者随机接受CHOP+RT或多柔比星、环磷酰胺、长春新碱、博来霉素和泼尼松(ACVBP)单药化疗联合序贯巩固,发现与R-CHOP联合放疗(剂量为40 Gy)相比,ACVBP治疗的患者的5年EFS和OS有所提高。然而,在比较不同的化疗方案时,3个周期ACVBP的剂量强度估计约为等效3个周期CHOP的150%。GELA-93-4研究发现,60岁以上局限期患者接受4个周期CHOP治疗或4个周期CHOP+RT治疗的结局无差异,但放疗组的继发性恶性肿瘤风险升高。 ECOG 1484进行的另一项研究也显示,8个周期的CHOP治疗后,RT对OS没有益处。即使日次,RT仍可提供极好的局部控制,在本研究的难治性患者中,RT组17例患者中仅3例在原始病变部位进展,而单独化疗组31例患者中有15例进展。
但问题是,上述研究中的患者人群不同,从而无法准确解读。特别是,纳入大包块患者、可变的smIPI风险评分和其他特征各不相同,从而难以直接对比每项研究的建议和结论。
化学免疫疗法和前PET时代的研究
利妥昔单抗的引入改善了DLBCL所有分期的生存期,包括局限期。在引入PET作为分期和缓解评估标志物之前,评价RT作用的前瞻性研究结果相互矛盾,至少需要部分纳入大包块疾病。
基于S8736,SWOG 0014研究将利妥昔单抗加入3个周期的CHOP和RT(剂量40-46 Gy)中。该研究排除了定义为> 10 cm的巨大疾病,并要求患者至少有一个smIPI不良风险因素。这项2期多中心研究的2年PFS为93%,4年PFS为88%;2年OS为95%,4年OS为92%。与S8736间接比 较时,4年PFS改善78%,4年OS改善88%。尽管纳入了不良风险因素更多的老年患者,但S0014研究表明化学免疫治疗可显著改善预后。
在接受利妥昔单抗联合化疗的患者中,巩固性RT影响如何?MD Anderson的一项回顾性研究考察了RT的影响,并得出结论:在利妥昔单抗时代治疗的所有DLBCL分期患者中(64%的局限期患者接受了6-8个周期的R-CHOP治疗),RT可改善PFS和OS,在局限期患者中,放疗患者5年OS为92%,5年PFS为82%,而未放疗的患者分别为73%和68%。但值得注意的是,本研究中的大包块定义为> 5 cm,未对更大尺寸定义的大包块进行单独分析。
LYSA/GOELAMS 02-03研究前瞻性研究评估了334例非大包块局限期DLBCL患者,随机分配至R-CHOP组(伴或不伴RT),它排除了为> 7 cm的大包块患者,但纳入了所有smIPI风险评分。所有患者接受至少4个周期R-CHOP联合/不联合放疗(40 Gy),smIPI > 1者再接受2个周期R-CHOP。R-CHOP治疗4个周期后,对所有患者进行PET缓解评估,完全缓解患者继续治疗,而部分缓解患者再接受2个周期的R-CHOP治疗。结果5年EFS无统计学显著差异,R-CHOP组和R-CHOP + RT组的5年EFS率分别为89%和92%,且R-CHOP组与R-CHOP + RT组间的5年OS无显著差异(分别为92%和96%)。该研究认为非大包块的局限期DLBCL(包括smIPI评分高的DLBCL)即使无RT也可获得极佳结局
UNFOLDER研究设计为2 x 2,评估R-CHOP治疗方案的获益,并纳入40 Gy剂量的RT。然而由于未接受RT组中的事件过多导致研究提前停止。然而,接受或未接受RT组之间的PFS或OS没有差异,包括仅大包块患者。
总的来说,尽管在利妥昔单抗时代,回顾性和小型研究提供的RT额外获益的证据存在矛盾,但LYSA/GOELAMS 02-03研究表明,对于非大包块患者,可省略RT且不影响预后。
化学免疫疗法和PET时代的研究
PET作为淋巴瘤标准影像学模式,它引入了局限期DLBCL另一个治疗决策的变量,对三个关键领域有所影响:分期、治疗结束(EOT)预后评估和反应适应性探索。
使用PET进行分期通常会导致“分期上调”,因其能够在35%的患者中检测到其他疾病部位,并导致12%的患者分期更高。一项回顾性研究显示,在IPI < 3的患者中,EOT扫描的阳性预测值(PPV)为56%,而IPI≥3的患者为80%。当用于监测复发时,PET的灵敏度为95%,特异性为97%。总体而言,EOT时PET扫描阴性预示预后极佳,不建议监测CT超过2年。
有几项前瞻性试验评估PET适应性策略在局限期DLBCL中的应用,以限制化疗和RT。
S1001研究前瞻性评估了3个R-CHOP周期后中期PET(iPET)扫描在非大包块疾病中的作用,iPET阴性(定义为Deauville评分≤3分)患者再接受1个周期的R-CHOP治疗,而iPET阳性患者先接受36 Gy RT,随后接受替伊莫单抗+利妥昔单抗放射免疫治疗。共128例患者纳入本研究,中位年龄62岁,Ⅰ期占62%,LDH升高占14%,头颈部受累占66%,结外受累占43%,纳入患者中27%的smIPI为零,42%为1,28%为2,4%为3。在这128例患者中,110例iPET阴性因此未接受RT,iPET阳性患者的5年PFS为86%,iPET阴性患者的5年PFS为89%,无统计学差异;同样,iPET阳性患者的5年OS为85%,iPET阴性患者的5年OS为91%,也无统计学差异。中位随访4.9年时,132例患者中仅6例复发。可见这种适应性PET可成功减少化学免疫治疗的周期数和放疗需求,疗效相当且预后极佳。
BCCA研究用基于PET的策略,在3个R-CHOP周期后,PET达到CR的患者再接受1个周期的R-CHOP治疗,而有残留病变证据的患者(国际协调项目标准或Deauville评分≥3)也接受了RT。结果80%的患者至少有一个smIPI风险因素,iPET阴性者的3年PFS为92%,3年OS为96%,而iPET阳性的患者分别为60%和83%。可见使用iPET的基于缓解的评估有望缩短化学免疫治疗时长和相关毒性,而对于iPET阳性的患者仍需要优化治疗。
LYSA组研究LNH 2009-1B进一步评估了早期PET在评估4个周期R-CHOP是否非劣于6个周期中的作用。在试验组中,2个周期后iPET阴性的患者共接受4个周期,而2个周期后iPET阳性的患者共接受6个周期。初步结果显示,中位随访5年后,接受6个周期R-CHOP治疗的标准组的3年PFS为89%,而试验组为92%。这种适应性PET方法的非劣效结果可使iPET阴性的患者接受简短的化学免疫治疗,也表明这部分患者在治疗较少也可获得极佳的结局。
多少免疫化疗足够?
历史上,化疗周期数仅在联合放疗时才缩短,而未联合放疗的研究常给予更多的累积细胞毒化。但是,是否可以在省略或减少放疗的同时减少化疗周期?有几项研究中的总生存率超过90%,因此最低危患者过度治疗可能是客观存在的。
随机化FLYER研究探讨了在局限期DLBCL患者中,4个周期的R-CHOP是否非劣于6个周期的R-CHOP。该研究入组了588例非大包块疾病且无不良IPI危险因素的患者,中位年龄为48岁,32%有结外受累,40%为II期疾病。结果显示4个周期的R-CHOP非劣于6个周期,4个周期者的3年PFS为96%,而6个周期者的3年PFS为94%。同样,4个周期的3年OS为99%,6个周期的3年OS为98%。
值得注意的是,FLYER研究仅纳入无不良IPI风险因素的患者,因此将这些结果外推至其他患者可能结局不同。但本研究仍为无风险因素的年轻患者设定了治疗标准,使其免除了更高剂量的累积化学免疫治疗
局限期DLBCL的特殊治疗考虑
随着现代局限期DLBCL治疗手段的发展,包括基于PET的缓解评估缩短了化学免疫治疗的疗程,并可能省略RT,因此仍需要考虑可能需要改良治疗方法的特殊人群。例如,关于高龄患者治疗的数据很少,作者多选择R-CHOP、R-mini-CHOP或R-CEOP,类似于晚期病变,但对于年轻患者需要限制与局限期疾病相似的治疗周期数。下文作者详细讨论了大包块、DHL和DEL、结外受累、CNS预防和全切病灶的患者。
大包块病变
在局限期DLBCL中大包块的定义各不相同;大多数局限期研究排除了II期大肿块患者,而大肿块I期病变相对罕见。其他研究的大包块II期病变类似于晚期DLBCL,但体积的临界值不同。上面讨论的FLYER、LYSA/GOELAMS 02-03、SWOG 0014和S1001等研究均排除了大包块病变患者,因此,对于大包块病变患者,必须谨慎应用许多结论。
UNFOLDER研究将大包块患者随机分配至化学免疫治疗联合/不联合RT,其中大包块定义为> 7.5 cm,并纳入结外病变。但由于大包块患者失败过多导致研究提前停止。这些事件归因于部分缓解患者需要局部RT;但接受或未接受RT的组之间PFS或OS无差异(3年PFS为89%vs 81%;3年OS均为93%)。
MD Anderson一项回顾性分析纳入了190例局限期患者,54%接受了放疗,48%为大包块(定义为直径> 5 cm),他们没有发现大包块与较差的预后相关(无论分期如何)。
大多数研究无法明确定义大包块的局限期疾病,部分原因是样本量过小。芬兰最近的一项回顾性研究旨在通过辅助使用iPET来回答这一突出问题,123例DLBCL患者有大包块(所有分期均有),其中44%接受了放疗,在局限期患者中,大包块与较差预后相关,2年PFS为53%,而非大包块患者为90%,但排除原发性难治性病例后,RT延缓至进展时间的获益消失。对于大包块病变,阴性iPET仍保留其有利的预后获益,阴性iPET大包块患者的2年PFS为87%,而阳性iPET患者为57%。虽然本质上是回顾性的,但该研究表明RT在大包块局限期疾病(如原发性难治性疾病)患者可提供额外益处,但也强调即使在存在其他风险因素的情况下,阴性iPET仍保留其预后能力,RT可能不是必需的。
双打击淋巴瘤和MYC/BCL2双表达
DHL和DEL在局限期疾病中的预后意义尚不完全明确。
之前一项评估DHL患者的回顾性研究表明,低危DHL患者可能从RT获益,延长复发时间。但最近一项针对局限期MYC重排患者的回顾性研究则显示,104例患者化学免疫治疗的ORR为91%,DHL患者的CR率仅75%,而仅MYC重排的CR率为98%;整个队列的2年PFS和OS分别为78%和86%,RT患者或DHL患者之间无差异;此外,对于局限期患者,对于仅MYC重排或DHL患者,使用强化的化学免疫治疗与R-CHOP相比均未显示获益。
总之,这些研究表明,局限期疾病的DHL或DEL患者的预后可能与晚期患者的预后不同,但仍需进一步研究来描述这些差异到底如何,并且目前对这些患者强化治疗的作用尚不明确。
结外受累
在利妥昔单抗时代,结外受累患者结局比淋巴结病变更差,但在局限期人群中的结果却相互矛盾。约50%的结外DLBCL病例为I期,因此与晚期疾病相比,在治疗方面带来了独特挑战。此外,与IPI不同,smIPI不认为多个结外病变部位是风险因素。
在上述讨论的研究中,LYSA/GOELAMS 02-03研究评估了RT联合4-6个周期R-CHOP治疗的作用,其纳入了结外病变患者,但未发现结外部位影响EFS或OS。S1001研究同样未发现结外受累结局更差。其他研究如FLYER排除了结外疾病患者,MInT允许临床医生自行决定使用RT,但未单独分析结外病变。
然而最近一项针对I期DLBCL患者的回顾性研究表明,结外病变的结局较差。341例Ⅰ期病例中66%有结外受累,最常见的部位是骨、胃、睾丸、肠、乳腺,其中69%的结外患者接受了RT,而无结外受累的患者为68%。结果发现,结外病变患者的结局更差,10年OS为70%,10年PFS为63%,而淋巴结疾病为89%和85%。此外巩固性RT与结外疾病OS和PFS改善相关。EOT PET扫描阳性的患者生存率并不低,但其中75%的患者接受了巩固性RT;而EOT PET阴性的患者未从RT中获得额外获益。所有复发均发生在照射野外,最常见的部位是淋巴结和中枢神经系统。只有8%的结外患者复发,在复发的患者中,30%在原发病部位复发。放疗后复发的患者均表现为远处复发部位。CNS复发者最初累及乳房和睾丸,提示对乳房受累者进行CNS预防可能有益。
相反, SWOG研究认为结外病变无不良影响,该回顾性分析纳入了研究S1001以及S0313和S0014中的非大包块患者,发现患者不管是结外还是仅有淋巴结病变,第10年的EFS或OS无显著差异。
另一项回顾性研究纳入了126例结外受累的I期DLBCL患者,还分析了复发模式,以及最常见的初始部位包括胃肠道、骨骼和鼻咽。且与上述研究一致,复发率为15%,79%的患者远端复发,25%的患者距离初次诊断> 5年。此外,32%的复发累及CNS,其中所有病例最初均累及睾丸(尽管进行了预防)、鼻咽和淋巴结。
比较特别的是,对于局限期睾丸疾病,尽管罕见(结外病例中约1%),但在I期和II期患者中联合使用R-CHOP、甲氨蝶呤鞘内预防和对侧睾丸放疗30 Gy,其5年PFS为74%,5年OS为85%。因此,化学免疫治疗联合放疗和CNS预防非常有效。
尽管需要进一步的前瞻性研究来确定结外病变额外治疗的作用,但总的来说纳入放疗仍存在争议。上述研究表明,通过结合EOT PET,这种基于缓解的评估能够更好地识别从巩固性RT中获益的结外病变。此外,结外病变的某些表现可能需要考虑CNS预防,讨论如下
CNS预防
目前尚无数据证实CNS预防在局限期病变中的适应症和/或实用性。在CNS-IPI评估时,与局限期疾病CNS复发风险最相关的因素是结外受累或累及被“高风险”的部位,如鼻窦。局限期疾病CNS复发风险相关研究表明,如果存在MYC重排则复发风险更高,而原发疾病部位无影响。此外,在复发中,1/3会发生CNS复发。
最近对CNS预防和所有分期DLBCL复发的回顾性审查发现,睾丸CNS复发的风险增加,但不同预防途径(全身达剂量甲氨蝶呤[HD-MTX]或鞘内甲氨蝶呤[IT-MTX])之间的CNS复发率没有差异。
由于缺乏复发率差异的证据,考虑到毒性发生率较低和全身治疗延迟,IT-MTX通常是预防的首选。
CNS预防治疗的NCCN指南虽未针对局限期疾病,但将高危疾病部位作为预防治疗的适应症,包括肾脏、肾上腺、睾丸和乳腺。其他回顾性研究也表明,累及鼻窦、乳房和睾丸等部位也应接受CNS预防。然而总体而言,目前没有足够的数据来明确指导关于CNS预防的决策。
全切病灶(Fully resected disease)
部分局限期DLBCL患者可在诊断性活检时(或其他特殊情况,如结外肠梗阻)切除整个肿瘤。传统上,这些患者的治疗持续时间与其他局限期疾病患者相同,但现在部分研究试图在亚组分析中探索,全切病灶是否可以简化治疗?尽管这一答案可能因初始病灶部位和其他考虑而异。
II期研究CISL 12-09旨在确定局限期病变全切后3个周期短R-CHOP的安全性和疗效。在中位随访39.5个月时,22例患者中仅1例发生疾病进展,预估2年OS为95%。在5年扩展随访中也未发生与疾病进展或死亡相关的其他事件。尽管研究规模小,但它支持全切的局限期DLBCL患者给予有限疗程的全身治疗。
PETAL研究中,对侵袭性非霍奇金淋巴瘤患者给予PET引导的治疗,分析后发现,52例患者经基线PET检查显示已全切I期病灶,后大多数患者接受了6个周期的R-CHOP治疗,60岁以下手术切除的患者2年PFS和OS均改善达到100%,而未全切的患者分别为92%和95%;60岁以上患者组间无统计学显著差异。此外,考虑到上述FLYER研究的结果,可以合理地外推,既4个周期的化学免疫治疗就足够。
一项回顾性研究中,250例原发性肠道局限期患者接受6个周期CHOP或R-CHOP治疗,结果联合手术和化疗组的CR率(85%)显著优于单独化疗组(64%),且后者局部复发率也更高。此外手术患者中,60%目的为肿块切除31%为梗阻;手术切除患者的3年PFS为82%,3年OS为91%,而单纯化疗为52%和62%。然而,在累及肠道疾病的晚期患者的手术切除中无生存获益。重要的是,这一发现表明,虽然在晚期疾病中手术切除不能提供生存获益,但在局限期的特定解剖学位置,手术切除可能是有意义的。
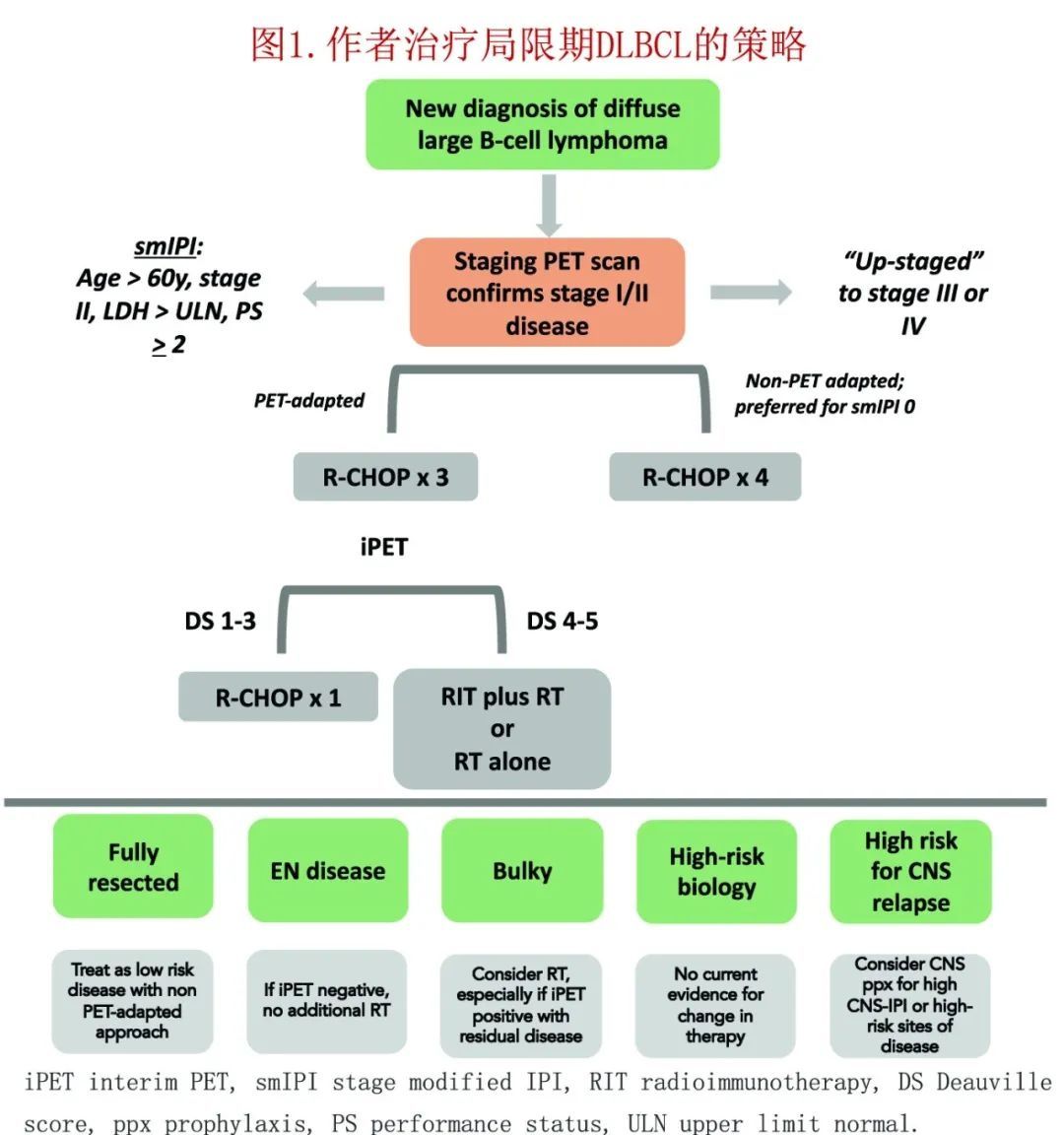
作者的治疗策略
目前局限期DLBCL患者的预后已经非常好,该领域已经发展到在不影响疗效的情况下限制短期和长期毒性。作者的治疗策略(见图1)是基于初始临床病理学特征,且结合了smIPI和中期PET扫描的结果。作者认为,smIPI低或iPET阴性的患者,包括全切病灶,最多可接受4个周期的R-CHOP治疗,无需巩固放疗;对于iPET阳性的患者,额外的放疗和/或额外的化学免疫治疗可能会带来生存获益。RT也可以是大包块(> 7.5 cm)或结外病变患者的考虑,当然上文讨论的个体患者还进行额外指导。这种策略可以最大限度地降低治疗的毒性,而不牺牲结局的获益;此外还需要考虑其他因素,如CNS预防高危部位如睾丸、乳腺和鼻咽受累;分期时疾病全切患者可以给予有限疗程治疗。
文章插图
参考文献
Alexandra E Rojek, Sonali M Smith.Evolution of therapy for limited stage diffuse large B-cell lymphoma.Blood Cancer J . 2022 Feb 24;12(2):33. doi: 10.1038/s41408-021-00596-z.
- 会议|育名医 创名科 建名院 桥头卫生院谋篇布局创品牌
- 《人世间》好人的结局凄苦!招人烦的角色没想到都有好结局
- 督导|市卫生健康局开展民营医疗机构疫情防控督导巡查
- 豹女|LOL-LPL:Creme瑞兹曲径折跃“崩撤卖溜”,OMG苦战三局不敌WBG
- 做一个有格局的女人,有这三种拒绝
- 东莞市|广东省东莞市卫生健康局:广东东莞新增8例本土新冠肺炎确诊病例累计报告19例
- 对阵|从春季赛开局三连胜,到如今的4-6!FPX越来越让人失望,为什么?
- 医保|祥符区医疗保障局组织开展2022年度第一批新增定点医药机构现场评估工作
- 集中采购|江源区医保局:落实国家药品集中采购政策 让老百姓用上便宜药
- 健康|达实旗云宣布完成对岱嘉医学战略投资,携手共创健康医疗大数据新格局
